题目内容
19.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水 易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
请回答下列问题:
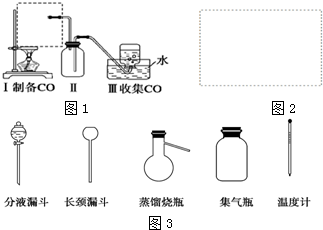
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是AD.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是使葡萄糖酸、HBr完全转化为钙盐;本实验中不宜用CaCl2替代CaCO3,理由是葡萄糖酸、HBr与CaCl2不反应生成葡萄糖酸钙沉淀.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出.
(5)第⑥步中,下列洗涤剂最合适的是C.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
分析 (1)反应在55℃条件下进行,需要水浴加热,且有冷凝回流装置;可用葡萄糖氧化酶催化作用下用氧气氧化葡萄糖,可生成葡萄糖酸;
(2)CaCO3固体需有剩余,可使葡萄糖酸完全反应,氯化钙易溶于水,易引入杂质,且葡萄糖酸与氯化钙不反应;
(3)趁热过滤,可避免葡萄糖酸钙的损失;
(4)由表中数据可知,葡萄糖酸钙微溶于乙醇,可避免损失;
(5)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去.
解答 解:(1)反应在55℃条件下进行,需要水浴加热,且有冷凝回流装置,题中A缺少回流装置,要滴加溴水,所以要有滴液漏斗,排除A,C缺少水浴加热,只有B符合;新制Cu(OH)2悬浊液、[Ag(NH3)2]OH溶液氧化性较弱,且反应需要碱性条件下进行,不利于葡萄糖的氧化,而酸性高锰酸钾氧化性较强,不能得到葡萄糖酸,可用葡萄糖氧化酶催化作用下用氧气氧化葡萄糖,可生成葡萄糖酸,
故答案为:B;AD;
(2)可使葡萄糖酸完全转化为葡萄糖酸钙,使葡萄糖酸、HBr完全转化为钙盐,则加入的碳酸钙应过量,因盐酸酸性比葡萄糖酸强,则加入氯化钙与葡萄糖酸、HBr难以反应,且易引入杂质,不易分离,应用碳酸钙,
故答案为:使葡萄糖酸、HBr完全转化为钙盐;葡萄糖酸、HBr与 CaCl2不反应;
(3)温度高时,葡萄糖酸钙的溶解度较大,趁热过滤,可避免葡萄糖酸钙的损失,
故答案为:葡萄糖酸钙冷却后结晶析出,如不趁热过滤会损失产品;
(4)由表中数据可知,葡萄糖酸钙微溶于乙醇,用乙醇洗涤可避免损失,有利于葡萄糖酸钙析出,
故答案为:可降低葡萄糖酸钙在溶剂中的溶解度,有利于葡萄糖酸钙析出;
(5)洗涤沉淀,应避免沉淀溶解,且能将沉淀吸附物冲洗去,可用乙醇-水混合溶液,如只用水,则造成葡萄糖酸钙溶解而损失,只用乙醇,不能将杂质全被洗去,
故答案为:C.
点评 本题为2014年浙江考题,侧重于物质的制备、分离和提纯的考查,着重于学生的分析能力和实验能力的考查,由于培养学生的良好的科学素养,难度中等.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
Ⅰ.火力发电燃煤排放的SO2会造成一系列环境和生态问题.利用海水脱硫是一种有效的方法,其工艺流程如图所示:
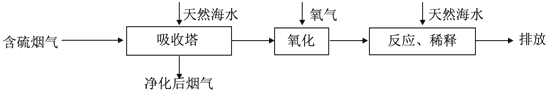
(1)天然海水的pH≈8,呈弱碱性.用离子方程式解释原因CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-.
(2)天然海水吸收了含硫烟气后,要用O2进行氧化处理,其反应的化学方程式是2H2SO3+O2=2H2SO4.
氧化后的“海水”需要用大量的天然海水与之混合后才能排放,该操作的主要目的是中和、稀释经氧气氧化后海水中生成的酸.
Ⅱ.重金属离子对河流及海洋造成严重污染.某化工厂废水(pH=2.O,p≈1g•mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol•L-1.排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
A.NaOH B.Na2S C.KI D.Ca(OH)2
(4)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=1.2×10-3mol•L-1.
(5)如果用食盐处理其只含Ag+的废水,测得处理后废水中NaCl的质量分数为0.117%.
若环境要求排放标准为c(Ag+)低于1.O×lO-8mol•L-1,问该工厂处理后的废水中c(Ag+)=9×10-9mol•L-1,是否符合排放标准是 (填“是”或“否”).已知KSP(AgCl)=1.8×l-10mol2•L2.
| A. | 其它条件不变,使用不同催化剂,该反应的平衡常数不变 | |
| B. | 平衡前,随着反应的进行,容器内压强始终不变 | |
| C. | 平衡时,其它条件不变,分离出少量的硫,正反应速率不变 | |
| D. | 平衡时,其他条件不变,升高温度可使反应速率加快,平衡常数减小 |