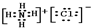题目内容
19..通常状况下,将1g 氢气在氯气中完全燃烧,放出92.4kJ热量,下列所示的热化学方程式正确的是( )| A. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=+92.4kJ/mol | B. | H2(g)+Cl2(g)═$\frac{1}{2}$HCl(g)△H=-92.4kJ/mol | ||
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-184.8kJ/mol | D. | H2(g)+Cl2(g)═2HCl(l)△H=+184.8kJ/mol |
分析 先计算出1mol氢气(2g)在氯气中燃烧放出的热量,然后利用热化学方程式的书写原则进行判断,注意通常情况下HCl为气态,据此进行解答.
解答 解:1mol氢气的质量为:2g/mol×1mol=2g,2g氢气在氯气中完全燃烧放出的热量为:92.4kJ×$\frac{2g}{1g}$=184.8kJ,
A.氢气与氯气的反应为放热反应,焓变应该为负值,故A错误;
B.该热化学方程式没有配平,正确的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=-184.8kJ/mol,故B错误;
C.2g氢气与氯气反应放出热量为184.8kJ,则该反应的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=-184.8kJ/mol,故C正确;
D.通常情况下HCl的状态为气态,正确的热化学方程式为:H2(g)+Cl2(g)═2HCl(g)△H=-184.8kJ/mol,故D错误;
故选C.
点评 本题考查了热化学方程式的书写,题目难度不大,明确热化学方程式的书写原则为解答关键,注意通常情况下HCl为气态,为易错点,试题有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
7.对于处于化学平衡状态的反应CO+H2O(g)?CO2+H2中,K正反应代表正反应的平衡常数,K逆反应代表逆反应的平衡常数,下列有关说法正确的是,( )
| A. | K正反应=K逆反应 | B. | K正反应>K逆反应 | ||
| C. | K正反应<K逆反应 | D. | K正反应×K逆反应=1 |
14.向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的HCO3-浓度的变化情况是( )
| A. | 逐渐增大 | B. | 逐渐减小 | ||
| C. | 先逐渐增大后减小 | D. | 先逐渐减小后增大 |
4.下列有关化学用语正确的是( )
| A. | 甲烷分子的球棍模型: | B. | NH4Cl的电子式: | ||
| C. | F原子的结构示意图: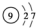 | D. | 中子数为20的氯原子${\;}_{17}^{37}$Cl |
11.下列物质中,含有非极性键的共价化合物是( )
| A. | Na2O2 | B. | CH3CH3 | C. | NaCl | D. | N2 |

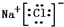 、
、