题目内容
10.在一个1L的密闭容器中,加入2mol A和1mol B,发生下列反应:2A(g)+B(g)?3C(g)+D(s),达到平衡时,C的浓度为1.2mol•L-1.(1)写出该反应的平衡常数表达式:K=$\frac{{c}^{3}(C)}{{c}^{2}(A)c(B)}$.
已知:K300℃>K350℃,则该反应是放热反应.
(2)可以说明可该反应已达到平衡的是:(b)(注意字母大小写)
(a) 单位时间内生成2n摩尔A,同时生成n摩尔B
(b) V逆(A)=2v正(B)
(c) 容器中A、B、C的物质的量为2:1:3
(d) 容器内的总压强不随时间变化而变化
(3)维持容器的温度不变,若缩小容器的体积,则平衡不移动(填“正反应方向”或“逆反应方向”或“不”).
(4)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol•L-1的是BD.
A.4mol A+2mol B
B.3mol C+1mol D
C.2mol A+1mol B+3mol C+1mol D
D.2mol A+1mol B+1mol D
(5)若维持容器内的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol•L-1,则C的起始物质的量应满足的条件是1.2 mol<n(C)≤3mol.
分析 (1)平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$,固体不能写入,K300℃>K350℃,温度越高平衡常数越小说明升温平衡逆向进行,逆反应为吸热反应,正反应为放热反应;
(2)当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意该反应是一个反应前后气体体积不变的可逆反应;
(3)维持容器的温度不变,若缩小容器的体积相当于增大压强,反应前后气体物质的量不变,说明增大压强平衡不变;
(4)反应2A(g)+B(g)?3C(g)+D(s),D为固体,D的量不影响平衡;在恒温恒容下,不同途径达到平衡后,C的浓度仍为1.2mol/L,说明与原平衡为等效平衡,按化学计量数转化到方程式的左边,只要满足n(A)=2mol,n(B)=1mol即可,据此进行分析;
(5)采用极限法求出C的物质的量,如果假设C全部反应转化为A、B,此时C的物质的量最小是1.2mol,当加入2mol A和1mol B,即加入3molC.
解答 解:(1)2A(g)+B(g)?3C(g)+D(s),平衡常数K=$\frac{{c}^{3}(C)}{{c}^{2}(A)c(B)}$,K300℃>K350℃,温度越高平衡常数越小说明平衡逆向进行,逆向进行逆反应为吸热反应,正反应为放热反应,
故答案为:$\frac{{c}^{3}(C)}{{c}^{2}(A)c(B)}$;放;
(2)2A(g)+B(g)?3C(g)+D(s),反应是气体体积不变的放热反应,结合平衡移动原理分析,
(a) 单位时间内生成2n摩尔A,同时生成n摩尔B,只能说明反应逆向进行,不能说明反应达到平衡状态,故(a)错误;
(b) 速率之比等于化学方程式计量数之比为正反应速率,速率v逆(A)=2v正(B),说明A的正逆反应速率相同,反应达到平衡状态,故(b)正确;
(c) 容器中A、B、C的物质的量为2:1:3,和化学方程式计量数之比相同,但不能说明正逆反应速率相同,故(c)错误;
(d) 反应前后气体物质的量不变,容器内的总压强始终不随时间变化而变化,不能说明反应达到平衡状态,故(d)错误;
故答案为:(b);
(3)2A(g)+B(g)?3C(g)+D(s),反应是气体体积不变的放热反应,维持容器的温度不变,若缩小容器的体积,相当于增大压强,平衡不变,则平衡不移动,故答案为:不;
(4)2A(g)+B(g)?3C(g)+D(s),根据等效平衡,把各物质都换算成方程式左边的物质,与初始加入的2molA和1molB相等或比值相同即可,
A、该反应是气体体积不变的反应,压强不影响平衡,开始加入4molA+2molB,与加入2molA和1molB达平衡的平衡为等效平衡,达到平衡时C的浓度为2.4mol/L,故A错误;
B.开始加入3molC+1molD,将3molC、1molD按化学计量数转化到左边可得2molA、1molB,故等效为开始加入2molA、2molB所到达的平衡,达到平衡时C的浓度为1.2mol/L,故B正确;
C.2mol A+1mol B+3mol C+1mol D,由于D为固态,不影响化学平衡,转化起始量为4molA和2molB,与起始量比值相同,则与原反应中2mol A和1molB互为等效平衡,达到平衡时C的浓度仍然为2.4mol/L,故C错误;
D.2mol A+1mol B+1mol D,由于D为固态,不影响化学平衡,则与原反应中2mol A和1molB互为等效平衡,达到平衡时C的浓度仍然为1.2mol/L,故D正确;
故答案为:BD;
(5)若维持容器的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol•L-1,此时和初始时是等效的,当加入2mol A和1mol B,即加入3molC,符合题意,如果假设C全部反应转化为A、B,此时C的物质的量最小是1.2mol,即1.2 mol<n(c)≤3mol,
故答案为:1.2 mol<n(C)≤3mol.
点评 本题考查的是平衡标志、平衡常数影响因素、等效平衡及化学平衡的有关计算、平衡移动原理放热分析应用,注意采用极限反应法求出C的物质的量,题目难度中等.

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案| A. | 该晶体属于分子晶体,可用作制冷材料 | |
| B. | 该晶体中碳原子在空间的分布结构与金刚石相似 | |
| C. | 该晶体的熔点低于二氧化硅 | |
| D. | 1mol 晶体中含 4 mol C-O 键 |
| A. | 能使溴水褪色 | B. | 能与新制Cu(OH)2悬浊液反应 | ||
| C. | 与足量的氢气反应生成1-丙醇 | D. | 不能发生银镜反应 |
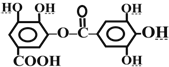
| A. | 该有机物的分子式为C14H10O9 | |
| B. | 常温下,与Na2CO3溶液反应放出CO2 | |
| C. | 与稀H2SO4共热,生成两种有机物 | |
| D. | 能发生碱性水解,1mol该有机物完全反应消耗8molNaOH |
| A. | 对于反应CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0,若使用催化剂,反应过程中放出的热量更多 | |
| B. | CO燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=+285.8kJ/mol | |
| C. | 反应2Mg+CO2=2MgO+C△H<0从熵变角度看,不可自发进行 | |
| D. | 在密闭容器中,2HI(g)?H2(g)+I2(g)△H=+14.9kJ/mol,若投入NA个HI分子,反应平衡时,吸热7.45kJ |
| A. | NA个Fe(OH)3胶体粒子的质量为107 g | |
| B. | 8.0 g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 标准状况下,2.24 L Cl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA | |
| D. | 1 mol Na2O2固体中含离子总数为4NA |
| A. | 干燥的蓝色石蕊试纸 | B. | 硝酸银溶液 | ||
| C. | 干燥的有色布条 | D. | 湿润的碘化钾淀粉试纸 |