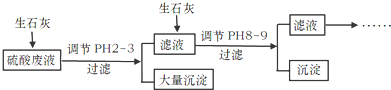
题目内容
15.下列叙述与图象对应符合的是( )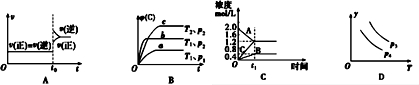
| A. | 对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,平衡逆向移动 | |
| B. | 对于反应 2A(g)+B(g)?C(g)+D(g)△H<0,p2>p1,T1>T2 | |
| C. | 该图象表示的化学方程式为:2A═B+3C | |
| D. | 对于反应 2X(g)+3Y(g)?2Z(g)△H<0,y可以表示Y的百分含量 |
分析 A、对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,c(NH3)立即增大,则V逆立即增大;
B、根据“定一议二”的原则,按照“先拐先平数值大”的规律来分析;
C、此反应最后达平衡,故为可逆反应;
D、从图象可知,温度T升高,y降低.
解答 解:A、对于达到平衡状态的N2(g)+3H2(g)?2NH3 (g)在t0时刻充入了一定量的NH3,c(NH3)立即增大,故V逆立即增大,由于反应物的浓度是在原来基础上逐渐增大,故V正在原来基础上逐渐增大,不会出现突变,故A错误;
B、根据“定一议二”的原则,将曲线a和b做对比可知压强p2>p1,将曲线b和c做对比可知温度T1>T2,故B正确;
C、根据图象可知,A为反应物,B和C为生成物,在t1时反应达平衡,A、B、C的浓度该变量分别为0.8mol/L、0.4mol/L和1.2mol/L,故A、B、C的计量数之比为2:1:3,由于此反应最后达平衡,故为可逆反应,故化学方程式为:2A?B+3C,故C错误;
D、从图象可知,温度T升高,y降低.而对于反应 2X(g)+3Y(g)?2Z(g)△H<0,升高温度,平衡左移,Y的百分含量升高,故y不能表示Y的百分含量,故D错误.
故选B.
点评 本题考查了化学平衡中的图象问题,应会从图象中提取有用的信息来加以加工,难度不大,注意“先拐先平数值大”规律的运用.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
5.下列说法中正确的是( )
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 用可见光束照射以区别溶液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3都是碱性氧化物 | |
| D. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
3.下列指定反应的离子方程式正确的是( )
| A. | 硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+═S↓+SO2↑+H2O | |
| B. | 向CuSO4溶液中通入H2S气体:Cu2++S2-═CuS↓ | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl- | |
| D. | 重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O═2H++2CrO42-(黄色) |
20.合成氨是人类科学技术上的一项重大突破,工业上以天然气为原料合成氨.其生产
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
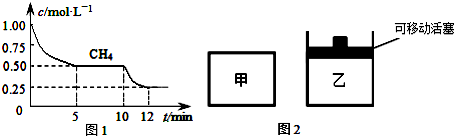
①在一个密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是升高温度等.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4)
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是a(填序号).
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是cd
a.v(N2)=3v(NH3) b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变 d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
工艺如下:造气阶段→转化阶段→分离净化→合成阶段
(1)造气阶段的反应为:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.1kJ/mol
①在一个密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图1所示,10min时,改变的外界条件可能是升高温度等.
②如图2所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O.在相同温度下发生反应,并维持反应过程中温度不变.则达到平衡时,两容器中CH4的转化率大小关系为:α甲(CH4)<α乙(CH4)

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)?CO2(g)+H2(g),在一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)合成氨反应为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
根据勒夏特列原理,简述提高合成氨原料转化率的一种方法增大压强或降低温度或分离液氨.
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.在某压强恒定的密闭容器中加入2mol N2和4mol H2,达到平衡时,N2的转化率为50%,体积变为10L.求:
①该条件下的平衡常数为400;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c 均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同.反应放出的热量<(填“>”“<”或“=”)92.4kJ.
③在一定温度下,在一个容积不变的密闭容器中,发生合成氨反应,下列能判断该反应达到化学平衡状态的是cd
a.v(N2)=3v(NH3) b.混合气体的密度不随时间改变
c.混合气体的平均相对分子质量不随时间改变 d.容器中的压强不随时间改变
e.c(N2)=c(NH3)
7.在酸性Fe(NO3)3溶液中逐渐通入H2S气体,不可能发生的离子反应是( )
| A. | 3H2S+2NO3-+2H+═2NO↑+3S↓+4H2O | |
| B. | 3Fe3++3NO3-+6H2S═3NO↑+6S↓+3Fe2++6H2O | |
| C. | Fe3++3NO3-+5H2S+2H+═3NO↑+5S↓+Fe2++6H2O | |
| D. | Fe3++9NO3-+14H2S+8H+═9NO↑+14S↓+Fe2++18H2O |
4.下列离子方程式书写正确的是( )
| A. | 将大理石投入到足量盐酸中:CO32-+2H+═CO2↑+H2O | |
| B. | 铁钉放入硫酸铁溶液中:Fe+Fe3+═2Fe2+ | |
| C. | 向AlCl3溶液中加入过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 将稀硫酸滴入氢氧化钡溶液中:Ba2++SO42-═BaSO4↓ |
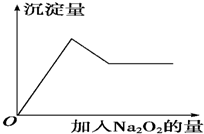 有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验