题目内容
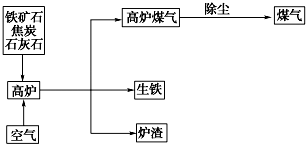
17.已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去).
试回答:
(1)写出化学式:K:Fe(OH)3 H:HCl
(2)反应⑦中A溶液显示的性质是:AD
(填序号:A、氧化性;B、还原性;C、酸性;D、碱性)
(3)若X是一种复盐(不考虑结晶水) X的化学式为:(NH4Fe(SO4)2
(4)写出下列反应的离子方程式:
反应②2NH4++Fe2++40H-=2NH3↑+Fe(OH)2+2H2O;
反应③Cl2+20H-=C1-+C1O-+H2O;
反应④2Fe2++Cl2=2Fe3++2Cl-.
分析 C、D为气体,反应①是工业生产中的重要反应,结合Y颜色反应为黄色,推知反应①为电解氯化钠溶液生成氢氧化钠、氯气和氢气,结合(3)可知,B为NaOH,C为Cl2,D为H2,H为HCl,A为NaClO;又反应④⑥⑧是实验室重要的物质检验反应,结合反应④产生白烟即NH3与HCl反应生成氯化铵,则E为NH3,G与钡盐产生白色沉淀,说明G中含SO42-,由⑦A(NaClO)与I生成红褐色沉淀K即Fe(OH)3,结合反应⑤I还能被氯气氧化,则说明I含二价铁离子,又F与H生成I,所以F为Fe(OH)2,I为FeCl2,J为FeCl3,结合反应②,则X中含有NH4+、Fe2+、及SO42-,据此解答.
解答 解:(1)由上述分析可知,K为Fe(OH)3,H为HCl,故答案为:Fe(OH)3;HCl;
(2)反应⑦为A溶液(NaClO)与FeCl2反应生成Fe(OH)3沉淀,所以A溶液显示的性质是氧化性和碱性,故答案为:AD;
(3)由上述分析可知,X中含有NH4+、Fe2+、及SO42-,又X是一种复盐(不考虑结晶水),则X的化学式为(NH4Fe(SO4)2,
故答案为:(NH4Fe(SO4)2;
(4)由上述分析可知,②2NH4++Fe2++40H-=2NH3↑+Fe(OH)2+2H2O;③Cl2+20H-=C1-+C1O-+H2O;④2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2NH4++Fe2++40H-=2NH3↑+Fe(OH)2+2H2O;Cl2+20H-=C1-+C1O-+H2O;2Fe2++Cl2=2Fe3++2Cl-.
点评 本题考查无机物的推断,物质的推断是解答本题的关键,注意反应①是工业生产中的重要反应为解答本题的突破口,题目难度中等.

练习册系列答案
相关题目
8.只含有一种元素的物质( )
| A. | 一定是一种单质 | B. | 可能是化合物 | ||
| C. | 一定是纯净物 | D. | 可能是纯净物,也可能是混合物 |
12.金属钠应保存在( )
| A. | 水中 | B. | CCl4中 | C. | 敞口容器中 | D. | 煤油中 |
2.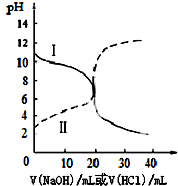 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
 25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )
25℃时,取浓度均为0.1mol•L-1的醋酸溶液和氨水溶液各20mL,分别用浓度均为0.1mol•L-1NaOH溶液和盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法不正确的是( )| A. | 曲线Ⅰ:滴加溶液到20 mL时溶液的pH=5则:c(H+)-c((NH3•H2O)=c(OH-)=1×10-9 mol•L-1 | |
| B. | 曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) | |
| D. | 曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
6.常温下,在10mL 0.01mol/L的NaOH溶液中,加入10mL某酸,再滴入紫色石蕊试液,溶液显红色,这种酸可能是( )
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
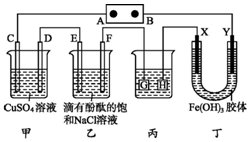 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.