题目内容
12.图甲为将Pt电极置于含有Cu2+和Ag+均为0.05mol•L-1的电解液中(阴离子为NO3-),图乙是图甲电解过程中消耗的电荷量与阴极的质量变化的关系图.下列说法错误的是( )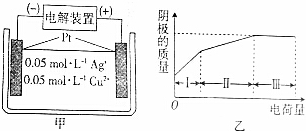
| A. | 区间Ⅰ,在阴极上有金属银析出 | |
| B. | 区间Ⅰ、Ⅱ、Ⅲ中溶液的pH均降低 | |
| C. | 区间Ⅱ,在阳极上有氧气放出 | |
| D. | 区间Ⅱ析出的固体质量是区间Ⅰ的2倍 |
分析 将Pt电极置于含有Cu2+和Ag+均为0.05mol•L-1的电解液中(阴离子为NO3-),在阴极上先后发生反应:Ag++e-=Ag,Cu2++2e-=Cu,在阳极上始终是氢氧根离子失电子的氧化反应,产生氧气,根据电极反应结合电子守恒来计算判断.
解答 解:将Pt电极置于含有Cu2+和Ag+均为0.05mol•L-1的电解液中(阴离子为NO3-),在阴极上先发生反应:Ag++e-=Ag,银离子全部放电,设溶液体积是1L,可以认为产生0.05mol的银,质量是5.4g,然后是铜离子放电Cu2++2e-=Cu,产生0.025mol即1.6g的Cu,
A、区间Ⅰ,在阴极上有金属银析出,故A正确;
B、开始阶段,在阴极上是金属阳离子放电,阳极上是氢氧根离子失电子,所以溶液显示酸性,到了后期,相当于电解水,溶液的pH均降低,故B正确;
C、电解过程中,在阳极上始终是氢氧根离子失电子的氧化反应,产生氧气,故C正确;
D、在阴极上先发生反应:Ag++e-=Ag,银离子全部放电,设溶液体积是1L,可以认为产生0.05mol的银,质量是5.4g,然后是铜离子放电Cu2++2e-=Cu,产生0.025mol即1.6g的Cu,区间Ⅱ析出的固体质量不是区间Ⅰ的质量的2倍,故D错误.
故选D.
点评 本题考查学生根据图象获取信息、运用知识综合分析能力,难度中等,注意电极反应是得书写和应用,关键在确定最先析出的固体是银.

练习册系列答案
相关题目
2.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | O.1mol/LKHC03溶液与O.1mol/L KOH溶液等体积混合,所得溶液中:c(K+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 20ml O.lmol/L CH3COONa溶液与lOmLO.lmol/L HCl溶液混合后溶液呈酸性,所得溶液中:C(Cl-)>(CH3COO-)>c(H+)>c(CH3COOH) | |
| D. | pH=2的H2C2O4溶液与pH=l2的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-) |
20.下列关于硫及其化合物的说法中正确的是( )
| A. | 自然界中不存在游离态的硫 | |
| B. | 二氧化硫能使滴有酚酞的氢氧化钠溶液褪色,体现了其漂白性 | |
| C. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| D. | 浓硫酸可用来干燥H2S、CO、Cl2等气体 |
1.下列关于化石燃料的加工说法正确的是 ( )
| A. | 煤干馏主要得到焦炭、煤焦油、粗氨水和焦炉气 | |
| B. | 石油裂化主要得到乙烯 | |
| C. | 石油分馏是化学变化,可得到汽油、煤油 | |
| D. | 煤的气化是在高温下煤和水蒸气作用转化为可燃性气体的过程,属于物理变化 |
6.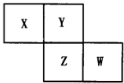 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A. | Z的单质与氢气反应较Y剧烈 | |
| B. | X、Y形成的化合物都易溶于水 | |
| C. | 这四种元素的单质以Z熔点最高 | |
| D. | 最高价氧化物对应水化物的酸性W比Z弱 |
 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
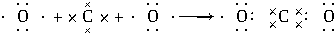 ,用电子式表示C、D两元素形成化学键的过程:
,用电子式表示C、D两元素形成化学键的过程: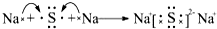 .
.