题目内容
2.实验室区别下列物质选用的试剂(括号中的为试剂,必要时可加热)正确的是( )| A. | 苯和己烷(溴水) | B. | 矿物油和植物油(NaOH溶液) | ||
| C. | 乙醛和丙烯酸(KMnO4溶液) | D. | 硝基苯和CCl4(水) |
分析 A.苯和己烷都不溶于水,且密度比水小;
B.植物油属于脂类物质;
C.乙醛含有醛基,丙烯酸含有碳碳双键,都可被氧化;
D.硝基苯和CCl4都不溶于水,且密度都比水大.
解答 解:A.苯和己烷都不溶于水,且密度比水小,用溴水不能鉴别,故A错误;
B.植物油属于脂类物质,可在碱性条件下水解,而矿物油属于烃类物质,故B正确;
C.乙醛含有醛基,丙烯酸含有碳碳双键,都可被氧化,应用碳酸钠溶液鉴别,故C错误;
D.硝基苯和CCl4都不溶于水,且密度都比水大,用水不能鉴别,故D错误.
故选B.
点评 本题考查有机物的鉴别,为高频考点,把握常见有机物的官能团与性质的关系为解答的关键,注意发生的有机反应及不同现象鉴别物质,题目难度不大.

练习册系列答案
相关题目
13.实验探究是体验知识的产生和形成过程的基本途径.下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管;CCl4在实验中所起的作用是萃取剂.
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
| 实验步骤 | 实验结论 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
10.在一定温度下,对于可逆反应A(g)+2B(g)?3C(g),已达到平衡的标志是( )
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内生成a mol A,同时生成2a mol B | |
| C. | 容器内各组分的总质量不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
17.某元素原子的核外有四个能层,最外能层有1个电子,该原子核内的质子数不可能为( )
| A. | 19 | B. | 24 | C. | 28 | D. | 29 |
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 分子间作用力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 分子间作用力 | D. | 分子间作用力 氢键 非极性键 |


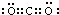 、
、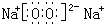 ;
;