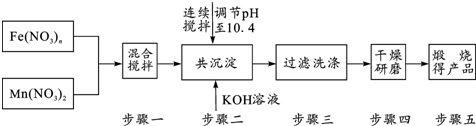
题目内容
12.中学常见物质A、B、C、D、E、X,存在图中转化关系(部分生成物和反应条件略去).下列推断不正确的是( )
| A. | 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是氯气 | |
| B. | 若D是一种强碱,则A、B、C均可与X反应生成D | |
| C. | 若D为NaCl,且A可与C反应生成B,则E一定是CO2 | |
| D. | 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C |
分析 A.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe;
B.若A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠;
C.若A为氢氧化钠、E为二氧化碳或二氧化硫、B为碳酸钠或亚硫酸钠、C为碳酸氢钠或亚硫酸氢钠、X为盐酸;
D.若D是一种强酸,如为硝酸,则A为氮气或氨气,B为NO,C为NO2,E为O2,X为H2O.
解答 解:A.若D是一种白色沉淀,在空气中最终变为红褐色说明D为Fe(OH)2,X为NaOH,C为Fe2+,B为Fe3+,A为Cl2,E为Fe,符合物质转化关系,故A正确;
B.若A为Na、E为氧气、B为氧化钠、C为过氧化钠、X为水、D为氢氧化钠,符合转化关系,Na、氧化钠、过氧化钠都能与水反应,故B正确;
C.若A为氢氧化钠、E为二氧化碳或二氧化硫、B为碳酸钠或亚硫酸钠、C为碳酸氢钠或亚硫酸氢钠、X为盐酸,符合转化关系,所以E不一定是二氧化碳,故C错误;
D.若D是一种强酸,如为硝酸,则A为氮气或氨气,B为NO,C为NO2,E为O2,X为H2O,稀硝酸与铜反应生成NO,浓硝酸与铜反应生成NO2,故D正确.
故选C.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握相关物质的性质,题目难度较大,注意相关基础知识的积累.

练习册系列答案
相关题目
2.单斜硫和正交硫转化为二氧化硫的能量变化如图所示,下列说法不正确的是( )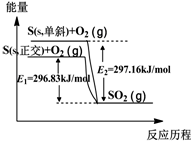

| A. | 单斜硫和正交硫互为同素异形体 | |
| B. | 正交硫比单斜硫稳定 | |
| C. | 相同物质的量的正交硫比单斜硫所含有的能量高 | |
| D. | 由单斜硫制取正交硫是一个放热反应 |
7.下列离子方程式书写正确的是( )
| A. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++2H+═3Fe2++H2↑ | |
| B. | 铜片放入稀硝酸中:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-═NH3↑+H2O | |
| D. | AlCl3溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
17. 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂的体积(V)的关系如图所示.(铵根和偏铝酸根不能共存)
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
1.关于氢键,下列说法正确的是( )
| A. | 水在结冰时体积膨胀,是由于水分子之间存在氢键 | |
| B. | 由于N、O、F的第一电离能较大,所以NH3、H2O、HF分子间可以形成氢键 | |
| C. | 只要有氢键,物质的熔点和沸点就会升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |