题目内容
9.下列实验操作中错误的是( )| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 碘的四氯化碳溶液可用萃取的方法分离出四氯化碳 | |
| D. | 配制稀硫酸时,先向烧杯中注入适量蒸馏水,再缓慢注入浓硫酸,并用玻璃棒不断搅拌 |
分析 A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出,否则溶液易混合;
B.蒸馏时,温度计测量馏分温度;
C.互溶的物质不能采用萃取方法分离;
D.稀释浓硫酸时,浓硫酸要倒入水中,并不断搅拌.
解答 解:A.分液时,为防止引入杂质,分液漏斗下层液体从下口放出,上层液体从上口倒出,故A不选;
B.蒸馏时,温度计测量馏分温度,所以应使温度计水银球靠近蒸馏烧瓶支管口,故B不选;
C.互溶的物质不能采用萃取方法分离,碘极易溶于四氯化碳,所以碘的四氯化碳不能采用萃取方法分离,应该采用蒸馏方法分离,故C选;
D.稀释浓硫酸时,浓硫酸要倒入水中,并不断搅拌,防止局部受热溅出液体,故D不选;
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查基本实验操作、物质分离和提纯等知识点,明确实验原理及基本操作方法是解本题关键,知道物质分离提纯方法的选取,题目难度不大.

练习册系列答案
相关题目
17.对下列各组物质:①KNO3和KCl②MnO2和MgCl2③Cu(OH)2和Fe(OH)3④BaCl2和BaCO3可按照溶解、过滤、蒸发的实验操作顺序,将它们相互分离的是( )
| A. | 只有① | B. | ②和③ | C. | ③和④ | D. | ②和④ |
14.甲乙丙是三种不含相同离子的可溶性强电解质.他们所含的离子如下表所示.取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法不正确的是( )
| 阳离子 | Na+NH4+Fe3+ |
| 阴离子 | OH- Cl- SO42- |
| A. | 甲中一定含有Na+ | B. | 乙中一定含有NH4+ | ||
| C. | 丙中一定含有 Fe3+ | D. | 丙中一定含有SO42- |
18.下列各组物质按纯净物、混合物、电解质、非电解质的顺序排列的是( )
| A. | 纯碱、氯水、氢氧化钠、干冰 | B. | 醋酸、盐酸、铜、氨气 | ||
| C. | 石灰石、石油、水、硫酸钡 | D. | 烧碱、海水、氯化钠、氯气 |
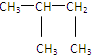 ⑩
⑩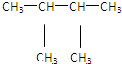 ⑪${\;}_{17}^{35}$Cl⑫
⑪${\;}_{17}^{35}$Cl⑫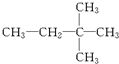

 .
.