题目内容
20.某研究性学习小组以元素周期律为课题研究“短周期元素在周期表中的分布”,他们提出元素在周期表中排布的四种方案: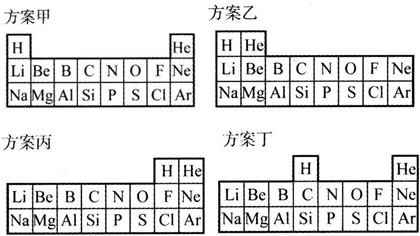
(1)这四种方案都有“合理”的理由,请填写表:
| “合理”的理由 | |
| 方案甲 | |
| 方案乙 | |
| 方案丙 | |
| 方案丁 |
A.H2O B.HCl C.NH4Cl D.NaH
(3)下列关系式中支持方案丁中把H放在第ⅣA族的是C.
A.最外层电子数=族序数
B.最高正化合价+|最低负化合价|=8
C.最高正化合价=|最低负化合价|
D.电子层数=周期数
(4)在短周期元素中,原子最外层只有1个或2个电子的元素是D.
A.金属元素
B.稀有气体元素
C.非金属元素
D.无法确定为哪一类元素.
分析 (1)甲是根据其最外层电子数及最外层电子数是否达到稳定结构判断;
乙是根据其原子最外层电子数排列;
丙是根据得失电子数判断;
丁是根据最外层电子数判断;
(2)方案丙中把H放在第ⅦA族是因为氢也可得到一个电子形成稳定结构,从而显-1价;
(3)方案丁中H和C、Si一样形成化合物时最高正化合价等于最低负化合价的绝对值;
(4)最外层电子数为1的短周期元素可以为非金属元素H,也可以是金属元素Li、Na等;最外层电子数为2的短周期元素可以为稀有气体元素He,也可以是金属元素Be、Mg等.
解答 解:(1)甲中H与Li、Na等第ⅠA族元素的原子最外层均有一个电子,He与Ne、Ar等稀有气体元素的原子最外层都已达稳定结构;
乙中He与Be、Mg等第ⅡA族元素的原子最外层电子数均为2;
丙中H与F、Cl等第ⅦA族元素的原子均可得一个电子形成稳定结构;
丁中H与C、Si等第ⅣA族的非金属元素原子都不易得到或失去电子形成稳定结构,
故答案为:
| “合理”的理由 | |
| 方案甲 | H与Li、Na等第ⅠA族元素的原子最外层均有一个电子,He与Ne、Ar等稀有气体元素的原子最外层都已达稳定结构 |
| 方案乙 | He与Be、Mg等第ⅡA族元素的原子最外层电子数均为2 |
| 方案丙 | H与F、Cl等第ⅦA族元素的原子均可得一个电子形成稳定结构 |
| 方案丁 | H与C、Si等第ⅣA族的非金属元素原子都不易得到或失去电子形成稳定结构 |
(3)方案丁中把氢放在第ⅣA族是因为氢和C、Si一样形成化合物时最高正化合价等于最低负化合价的绝对值,故选C;
(4)最外层电子数为1的短周期元素可以为非金属元素H,也可以是金属元素Li、Na等;最外层电子数为2的短周期元素可以为稀有气体元素He,也可以是金属元素Be、Mg等,故无法确定为哪一类元素,故选D.
点评 本题考查元素周期表结构及元素排列,为高频考点,侧重考查学生分析总结归纳能力,根据原子核外电子排布特点来分析解答,题目难度不大.

练习册系列答案
相关题目
10.V mL Al2(SO4)3溶液中含有Al3+a g,取$\frac{V}{4}$mL溶液稀释到4V mL,则稀释后溶液中SO42-的物质的量浓度是( )
| A. | $\frac{a}{288V}$mol/L | B. | $\frac{125a}{36V}$mol/L | C. | $\frac{125a}{18V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
11.下列叙述不正确的是( )
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
12.1874年22岁的范特霍夫和27岁的勒贝尔分别提出碳正四面体学说,建立了分子的立体概念.如图所示均能表示甲烷的分子结构,哪一种更能反映其真实存在状况( )
| A. | 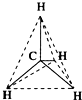 结构示意图 | B. |  电子式 | C. | 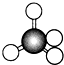 球棍模型 | D. | 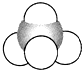 比例模型 |
10.下列有关阿伏加德罗常数NA的说法正确的是( )
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
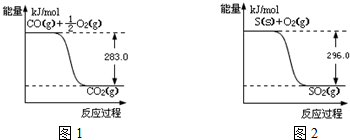
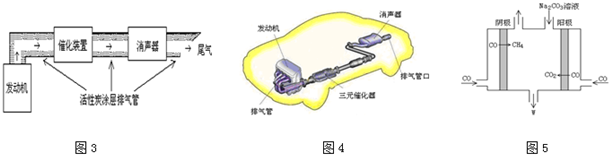
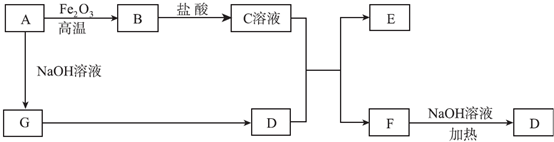
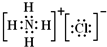 ;
; [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.