题目内容
14.在一恒温恒容容器内发生反应:C(s)+H2O(g)═CO(g)+H2(g).下列条件不能确定上述可逆反应己达到化学平衡状态的是( )| A. | 体系的压强不再发生变化 | |
| B. | 气体密度不再发生变化 | |
| C. | 生成nmol CO的同时消耗n mol H2O | |
| D. | 1 molH一H键断裂的同时断裂2 mol H-O键 |
分析 可逆反应C(s)+H2O(g)═CO(g)+H2(g)达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,注意C的状态为固态.
解答 解:A.该反应为气体体积增大的反应,压强为变量,当体系的压强不再发生变化,说明正逆反应速率相等,反应达到平衡状态,故A不选;
B.反应中C为固态,反应前后气体质量发生变化,容器容积不变,则密度为变量,当气体密度不再发生变化时,表明各组分的浓度不再变化,反应达到平衡状态,故B不选;
C.生成nmol CO的同时消耗n mol H2O,表示的都是正反应速率,无法判断该反应是否达到平衡状态,故C选;
D.1 molH-H键断裂的同时断裂2 mol H-O键,表示的是正逆反应速率,且满足计量数关系,说明该反应已经达到平衡状态,故D不选;
故选C.
点评 本题考查化学平衡状态的判断,题目难度不大,明确化学平衡状态的特征为解答关键,B为易错点,注意C的状态为固体,试题培养了学生的灵活应用能力.

练习册系列答案
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案
相关题目
4. 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)?N2(g)+CO2(g).向容积均为l L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
甲容器反应温度T℃>400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=6.25×10-3mol/(L•min);丙容器中达平衡后NO的物质的量为0.4mol.
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,l mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中NO2的转化率最高的是A点(填“A”或“B”或“C”).
②计算C点时该反应的压强平衡常数KP=4MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)燃煤烟气脱硫常用如下方法.
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫.涉及的部分反应如下:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H1=8.0KJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H2=-566.0KJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H3=-483.6 1KJ•mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ/mol.
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4.
实验测得NH4HSO3溶液中$\frac{c(S{O}_{3}^{2-})}{c({H}_{2}S{O}_{3})}$=15,则溶液的pH为5;向该溶液中加氨水使溶液呈中性时,$\frac{c(N{H}_{4}^{+})}{c(S{O}_{3}^{2-})}$=3.(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
 消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.
消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题.(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s)?N2(g)+CO2(g).向容积均为l L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如表所示:
| t/min n(NO)/mol T | 0 | 40 | 80 | 120 | 160 | |
| 甲 | T℃ | 2 | 1.45 | 1 | 1 | 1 |
| 乙 | 400℃ | 2 | 1.5 | 1.1 | 0.8 | 0.8 |
| 丙 | 400℃ | 1 | 0.8 | 0.65 | 0.53 | 0.45 |
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s)?N2(g)+2CO2(g),在恒温条件下,l mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
①A、B、C三点中NO2的转化率最高的是A点(填“A”或“B”或“C”).
②计算C点时该反应的压强平衡常数KP=4MPa(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
(3)燃煤烟气脱硫常用如下方法.
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫.涉及的部分反应如下:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H1=8.0KJ•mol-1
2CO(g)+O2(g)═2CO2(g)△H2=-566.0KJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H3=-483.6 1KJ•mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ/mol.
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4.
实验测得NH4HSO3溶液中$\frac{c(S{O}_{3}^{2-})}{c({H}_{2}S{O}_{3})}$=15,则溶液的pH为5;向该溶液中加氨水使溶液呈中性时,$\frac{c(N{H}_{4}^{+})}{c(S{O}_{3}^{2-})}$=3.(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
5.下列关于Na2CO3溶液中离子浓度的说法正确的是( )
| A. | c(Na+)>2c(CO32-) | B. | C(Na+)+c(H+)═c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | C(Na+)═2[c(HCO3-)+c(CO32-)+c(H2CO3)] | D. | C(OH-)═c(HCO3-)+c(H+)+c(H2CO3) |
2.金刚石与C60互称( )
| A. | 同一种物质 | B. | 同位素 | C. | 同素异形体 | D. | 同分异构体 |
9.已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10)如图,则下列判断错误的是( )


| A. | L是极性分子,G是非极性分子 | |
| B. | M分子中含2个π键和1个σ键 | |
| C. | E极易溶于水的原因是与水分子形成氢键 | |
| D. | E分子中键角为104.5° |
19.下列物质发生变化时,克服的微粒间的相互作用力属于同种类型的是( )
| A. | 液溴和苯分别受热变为气体 | B. | 干冰和氣化铵分别受热变为气体 | ||
| C. | 氧化硅和铁分别受热熔化 | D. | 食盐和葡萄糖分别溶解在水中 |
4.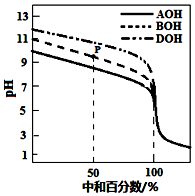 室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
 室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )
室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol•L-1的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是( )| A. | 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大 | |
| B. | 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+) | |
| C. | pH=7时,三种溶液中c(Cl-) 相等 | |
| D. | 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-) |
 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如图所示.