题目内容
(1)配制500mL 0.2mol/L NaOH溶液需要取用NaOH的质量是多少g?
(2)取上述溶液20mL稀释成100mL后,其物质的量浓度是多少?
(2)取上述溶液20mL稀释成100mL后,其物质的量浓度是多少?
考点:物质的量的相关计算
专题:
分析:(1)根据n=cV计算NaOH物质的量,再根据m=nM计算NaOH的物质的量;
(2)根据稀释定律计算稀释后NaOH溶液的浓度.
(2)根据稀释定律计算稀释后NaOH溶液的浓度.
解答:
解:(1)NaOH物质的量为0.5L×0.2mol/L=0.1mol,需要NaOH的物质的量为0.1mol×40g/mol=4.0g,
答:需要氢氧化钠的质量为4.0g;
(2)设稀释后NaOH溶液浓度为c,根据稀释定律,稀释前后氢氧化钠的物质的量不变,则:
0.02L×0.2mol/L=0.1L×c
解得c=0.04mol/L
答:稀释后氢氧化钠溶液的难度为0.04mol/L.
答:需要氢氧化钠的质量为4.0g;
(2)设稀释后NaOH溶液浓度为c,根据稀释定律,稀释前后氢氧化钠的物质的量不变,则:
0.02L×0.2mol/L=0.1L×c
解得c=0.04mol/L
答:稀释后氢氧化钠溶液的难度为0.04mol/L.
点评:本题考查物质的量有关计算,比较基础,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求,ClO2将逐渐取代Cl2成为自来水的消毒剂.工业上ClO2常用NaClO3和Na2SO3溶液混合并加入H2SO4酸化后反应制得,在该反应中NaClO3和Na2SO3的物质的量之比为( )
| A、3:1 | B、2:3 |
| C、1:2 | D、2:1 |
下列化学用语正确的是( )
| A、乙烯的结构简式:CH2CH2 |
B、氟原子的结构示意图: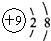 |
C、甲烷的电子式: |
| D、磷酸钠的电离方程式:Na3PO4=Na33++PO43- |
VLFe2(SO4)3溶液中含有a克SO42-的溶液取0.5VL,用水稀释至2VL,则稀释后溶液中Fe3+的物质的量的浓度为( )
| A、a/576V mol?L-1 |
| B、a/125 mol?L-1 |
| C、250a/36V mol?L-1 |
| D、250a/48V mol?L-1 |
设阿伏加德罗常数为NA,标准状况下,m g N2气体含有b个分子,则n g N2在相同状态下的体积为 (单位为L)( )
A、
| ||
B、
| ||
C、
| ||
D、
|
在标准状况下,若VL甲烷中含有的氢原子个数为n,则阿伏加德罗常数可表示为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
NA表示阿伏加德罗常数值,下列说法正确的是( )
| A、18g水所含电子数为NA |
| B、14g CO和N2的混合气体所含分子数为NA |
| C、16g O2和O3的混合气体所含原子数为NA |
| D、58.5g NaCl所含的离子数为NA |

