题目内容
 A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍.
A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍.请回答下列问题:
(1)由上述元素组成的下列物质中属于非电解质的是
a.A2B b.DB2 c.AE d.C2DB3
(2)D元素在元素周期表中的位置为
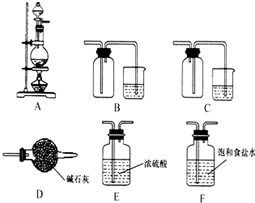
(3)实验室中欲选用下列装置制取并收集纯净干燥的E2气体.
①实验中应选用的装置为
②装置A中发生反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子,则A为H;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍,C应为Na,设B的原子序数为x,D的原子序数为x+8,则2×(1+11)=x+x+8,解得x=8,则B为O,D为S,E为Cl.
(1)H2O、HCl、Na2SO3均为化合物,均可发生电离,而SO2本身不能电离;
(2)D为S,化合物CBA为NaOH,C2B中离子具有相同电子排布,原子序数大离子半径小;
(3)装置制取并收集纯净干燥的Cl2气体,选择浓盐酸与二氧化锰加热制备,饱和食盐水除杂,浓硫酸干燥,最后收集及尾气处理.
(1)H2O、HCl、Na2SO3均为化合物,均可发生电离,而SO2本身不能电离;
(2)D为S,化合物CBA为NaOH,C2B中离子具有相同电子排布,原子序数大离子半径小;
(3)装置制取并收集纯净干燥的Cl2气体,选择浓盐酸与二氧化锰加热制备,饱和食盐水除杂,浓硫酸干燥,最后收集及尾气处理.
解答:
解:A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子,则A为H;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍,C应为Na,设B的原子序数为x,D的原子序数为x+8,则2×(1+11)=x+x+8,解得x=8,则B为O,D为S,E为Cl.
(1)H2O、HCl、Na2SO3均为化合物,均可发生电离,而SO2本身不能电离,则只有b为非电解质,故答案为:b;
(2)D为S,位于第3周期ⅥA族,化合物CBA为NaOH,含离子键、共价键;C2B中离子具有相同电子排布,原子序数大离子半径小,离子半径为O2->Na+,
故答案为:第3周期ⅥA族;离子键、共价键;O2-;Na+;
(3)①装置制取并收集纯净干燥的Cl2气体,选择浓盐酸与二氧化锰加热制备,饱和食盐水除杂,浓硫酸干燥,最后收集及尾气处理,则仪器连接顺序为AFEB,
故答案为:AFEB;
②装置A中发生反应的化学方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(1)H2O、HCl、Na2SO3均为化合物,均可发生电离,而SO2本身不能电离,则只有b为非电解质,故答案为:b;
(2)D为S,位于第3周期ⅥA族,化合物CBA为NaOH,含离子键、共价键;C2B中离子具有相同电子排布,原子序数大离子半径小,离子半径为O2->Na+,
故答案为:第3周期ⅥA族;离子键、共价键;O2-;Na+;
(3)①装置制取并收集纯净干燥的Cl2气体,选择浓盐酸与二氧化锰加热制备,饱和食盐水除杂,浓硫酸干燥,最后收集及尾气处理,则仪器连接顺序为AFEB,
故答案为:AFEB;
②装置A中发生反应的化学方程式为MnO2+4HCl(浓)
| ||
| ||
点评:本题考查位置、结构及性质的应用,为高频考点,把握原子结构及元素化合物性质为解答的关键,侧重分析与推断能力的考查,综合性较强,题目难度不大.

练习册系列答案
相关题目
在下列物质分类中,前者包括后者的是( )
| A、氧化物 化合物 |
| B、溶液 分散系 |
| C、溶液 胶体 |
| D、化合物 电解质 |
化学与生产、生活密切相关.下列说法正确的是( )
| A、硅胶吸附能力强,常用作催化剂载体和食品干燥剂 |
| B、福尔马林可用于保存海鲜产品 |
| C、天然纤维和合成纤维的主要成分都是纤维素 |
| D、工业上利用Cl2与澄清石灰水反应制取漂白粉 |
阿司匹林是一种常用的解热镇痛药,其结构简式如图,其不可能有的性质为( )
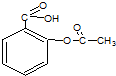

| A、该物质可以与氢气发生加成 |
| B、该物质能发生酯化反应 |
| C、该物质可水解生成水杨酸 |
| D、该物质极易溶于水和有机溶剂 |


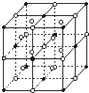 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.