题目内容
已知101KPa时辛烷的标准燃烧热为—5518kJ·mol-1,含20gNaOH的稀溶液与稀盐酸充分反应放出热量28.7kJ,则下列热化学方程式书写正确的是
①C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(g); △H = +5518 kJ·mol-1
②C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = -5518 kJ·mol-1
③H+(aq)+ OH-(aq)= H2O(l); △H = -57.4 kJ·mol-1
④HCl (aq) + NaOH(aq) =NaCl(aq) + H2O(l); △H = —28.7 kJ·mol-1
A.①③ B.②③ C.②④ D.②
B
【解析】
试题分析:燃烧热是1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,焓变小于零,②正确;中和热是强酸与强碱中和生成1mol水时放出的热量,20g氢氧化钠是0.5mol,放热28.7kJ,③正确;答案选B。
考点:燃烧热、中和热

相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g)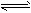 2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
2NH3 (g),△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q=23. 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0.5L,则平衡时放出的热量小于23. 15kJ