题目内容
15.下列叙述或实验方案不合理的是( )| A. | 电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极产生的Cl2进入阳极室 | |
| B. | 用水可以一次性鉴别硝基苯、甲苯、冰醋酸三种物质 | |
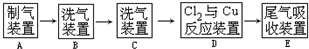
| C. | 制硫酸和氢氧化钠:用如图所示装置 (注:b为阴离子交换膜、c为阳离子交换膜) (注:b为阴离子交换膜、c为阳离子交换膜) | |
| D. | 乙醛的氧化:在试管里加入10%的NaOH溶液2 mL,滴入2%的CuSO4溶液4滴~6滴,振荡后加入乙醛溶液0.5 mL,加热至沸腾 |
分析 A.电解饱和食盐水时,阳极上氯离子放电生成氯气;
B.硝基苯和甲苯都不溶于水,硝基苯密度大于水而甲苯密度小于水,冰醋酸易溶于水;
C.电解硫酸钠溶液制取硫酸和NaOH时,阳极上OH-放电生成O2,阳极附近有大量H+生成,要想生成硫酸,还需要SO42-;阴极上H+放电生成氢气,阴极附近有大量OH-生成,要想生成NaOH,还需要Na+;
D.乙醛和新制氢氧化铜悬浊液发生氧化反应需要加热、碱性条件.
解答 解:A.电解饱和食盐水时,阳极上氯离子放电生成氯气,所以为防止阳极生成的氯气进入阴极室,采用离子交换膜,故A错误;
B.硝基苯和甲苯都不溶于水,硝基苯密度大于水而甲苯密度小于水,冰醋酸易溶于水,所以甲苯和水混合时分层且水在下层,硝基苯和水混合时分层且硝基苯在下层,冰醋酸和水互溶而不分层,可以用水鉴别这三种物质,故B正确;
C.电解硫酸钠溶液制取硫酸和NaOH时,阳极上OH-放电生成O2,阳极附近有大量H+生成,要想生成硫酸,还需要SO42-;阴极上H+放电生成氢气,阴极附近有大量OH-生成,要想生成NaOH,还需要Na+,则b为阴离子交换膜、c为阳离子交换膜,故C正确;
D.乙醛和新制氢氧化铜悬浊液发生氧化反应需要加热、碱性条件,所以制备氢氧化铜悬浊液时NaOH要过量,故D正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及电解原理、物质鉴别、官能团检验等知识点,明确实验原理、物质性质差异性是解本题关键,注意离子交换膜的作用和阴阳离子交换膜的选取,题目难度不大.

练习册系列答案
相关题目
5.《汉书》记载“高奴(县)有洧水可燃”;《梦溪笔谈》描述“洧水”:“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”.上述有关“洧水”和“烟”的主要成分分别是( )
| A. | 石油和炭黑 | B. | 石油和焦炭 | C. | 油脂和木炭 | D. | 油脂和石墨 |
6.下列说法不正确的是( )
| A. | 生物酶固氮相比人工固氮更高效、条件更温和 | |
| B. | 透过观察颜色容易区分黄金与铜锌合金 | |
| C. | 近日用地沟油炼制的生物航油载客首飞,标志着我国航空业在节能减排领域进入商业飞行阶段 | |
| D. | 尿液燃料电池的原理是在微生物作用下将尿液中的有机物转化为电能 |
3.Ⅰ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
(1)从甲组情况分析,(填“能”或“不能”)不能判断HA是强酸还是弱酸.
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
Ⅱ.某二元酸(化学式用H2B表示)水溶液电离是:H2B=H++HB- HB-?H++B2-.
回答下列问题:
(6)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是A.
A.c( B2-)+c(HB-)=0.1mol/L
B.c(Na+)=2( c( B2-)+c(HB-)+c(H2B))
C.c(OH-)=c(H+)+c(HB-)+2c(H2B)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)+c( B2-)
| 实验编号 | HA的物质的量浓度(mol•L-1) | NaOH的物质的量浓度(mol•L-1) | 混合后溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)相等,则乙组混合溶液中存在3个动态平衡.
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+)
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-4-10-10mol•L-1
(5)用离子方程式解释丁溶液pH=10的原因是A-+H2O?HA+OH-.
Ⅱ.某二元酸(化学式用H2B表示)水溶液电离是:H2B=H++HB- HB-?H++B2-.
回答下列问题:
(6)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是A.
A.c( B2-)+c(HB-)=0.1mol/L
B.c(Na+)=2( c( B2-)+c(HB-)+c(H2B))
C.c(OH-)=c(H+)+c(HB-)+2c(H2B)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)+c( B2-)
10.某有机物的结构简式如图所示,下列有关叙述正确的是( )


| A. | 具有4个官能团,氯原子、苯基、羟基和羧基 | |
| B. | 具有羧基,能与醇类物质发生酯化反应 | |
| C. | 具有酚羟基,所以能与NaHCO3溶液反应生成CO2 | |
| D. | 具有氯原子,在氢氧化钠醇溶液中加热,可发生消去反应 |
7.下列说法正确的是( )
| A. | 聚乙烯固定的熔沸点,其可由乙烯通过加聚反应合成 | |
| B. | 有机物的种类繁多,分子中含有碳、氢元素的物质即为有机物 | |
| C. | 石油的分馏和煤的干馏均属于物理变化 | |
| D. | 不是所有的有机物中都含有一种或多种官能团 |