题目内容
18.PM2.5微细粒子包含(NH4)2SO4、NH4NO3等.①(NH4)2SO4晶体中各种微粒间的作用力不涉及de(填序号).
a.离子键 b.共价键
c.配位键 d.范德华力 e.氢键
②NH4NO3中阳离子的空间构型为正四面体,阴离子的中心原子轨道采用sp2杂化.
分析 ①(NH4)2SO4晶体中含铵根离子与硫酸根离子之间的离子键、N-H和S-O共价键;
②铵根离子中氮原子价层电子对个数是4且不含孤电子对,硝酸根离子中价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论确定离子空间构型及原子杂化方式.
解答 解:①(NH4)2SO4晶体中铵根离子和硫酸根离子之间是离子键,而铵根离子和硫酸根离子内部都是共价键,其中铵根离子内部含一个配位键,但硫酸铵中不存在范德华力和氢键,选de;
②NH4+ 的中心原子氮原子价层电子对数=$\frac{5+4-1}{2}$=4,孤电子对=$\frac{5-1×4-1}{2}$=0,所以NH4+ 的空间构型为正四面体,NO3-的中心原子氮原子价层电子对数=$\frac{5+1}{2}$=3,所以氮原子按sp2方式杂化,
故答案为:正四面体;sp2.
点评 本题考查化学键和原子杂化,为高频考点,把握化学键的形成、原子杂化计算方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.化学与人类生产、生活密切相关,下列说法正确的是( )
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 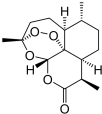 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
9.下列各组物质中,所含分子数相等的是( )
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
6.标准状况下呈液态的物质为( )
| A. | Fe | B. | N2 | C. | CH3CH2OH | D. | CO |
3.化学与人类生产、生活、社会可持续发展密切相关.下列说法正确的是( )
| A. | 玛瑙手饰所用材料的主要成分为硅酸盐 | |
| B. | 汽油去油污、焰色反应、煤的气化均属于物理变化 | |
| C. | 用CO2合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 利用太阳能电池电解法将CO和H2O转化为甲酸的能量转化方式只有一种 |
10.下列叙述正确的是( )
| A. | 二氯甲烷有两种同分异构体 | |
| B. | 苯和苯的同系物均能使酸性高锰酸钾溶液褪色 | |
| C. | 用核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 一定条件下,溴乙烷既能发生取代反应又能发生消去反应 |
12.配制100mL0.5mol/LNaOH溶液的操作有:①计算 ②冷却 ③洗涤 ④溶解 ⑤转移 ⑥称量 ⑦定容,次序正确的是( )
| A. | ①⑥③②⑤④⑦ | B. | ①⑥④②⑤③⑦ | C. | ①⑥④⑤②③⑦ | D. | ①⑥③④⑤②⑦ |
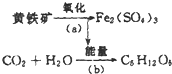 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: