题目内容
20.在一定条件下,反应A(g)+B(g)?C(g)△H<0,达平衡后,在下列空格填入对应图的序号:
(1)升温:B
(2)减压:C
(3)减少C的量:E
(4)增加A的量:A
(5)使用催化剂:D.
分析 (1)升温,化学反应速率加快,反应向着吸热方向进行;
(2)减压,正逆反应速率减慢,反应向着气体系数和增加的方向进行;
(3)减少C的量:正逆反应速率减慢,但是平衡正向移动,所以正反应速率大于逆反应速率;
(4)增加A的量:正逆反应速率加快,但是平衡正向移动,所以正反应速率大于逆反应速率;
(5)使用催化剂:正逆反应速率都加快,但是不会引起化学平衡的移动.
解答 解:(1)升温,正逆化学反应速率迅速加快,反应向着吸热方向进行,即向着逆向进行,所以逆反应速率大于正反应速率,故选B;
(2)减压,正逆反应速率都减慢,反应向着气体系数和增加的方向即逆向进行,所以逆反应速率大于正反应速率,故选C;
(3)减少C的量:正逆反应速率减慢,逆反应速率迅速减慢,但是平衡正向移动,所以正反应速率大于逆反应速率,故选E;
(4)增加A的量:正逆反应速率加快,但是平衡正向移动,所以正反应速率大于逆反应速率,故选A;
(5)使用催化剂:正逆反应速率都加快,但是不会引起化学平衡的移动,故选D.
点评 本题综合考查学生化学反应速率和化学平衡的移动的影响因素等知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
相关题目
18.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,2.24L H2O中含有极性共价键的数目为0.2NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由CH4和C2H4组成的混合气体中含有氢原子的数目为2NA |
8.如图所示为硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),从图中获取如下信息,不正确的有 ( )
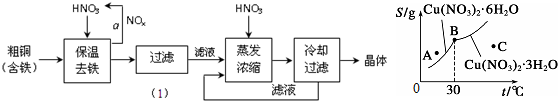

| A. | C点溶液为Cu(NO3)2的不饱和溶液 | |
| B. | 30℃时结晶可析出两种晶体 | |
| C. | 按上述流程最终得到的晶体是Cu(NO3)2•3H2O | |
| D. | 将A点溶液升温至30℃时,可以析出Cu(NO3)2•3H2O晶体. |
15.用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )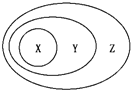

| X | Y | Z | |
| 例 | 氧化物 | 化合物 | 纯净物 |
| A | 溶液 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 强电解质 | 电解质 | 化合物 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A. | A | B. | B | C. | C | D. | D |
5.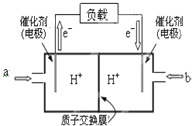 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)如图是某笔记本电脑用甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
已知反应N2(g)+3H2(g)?2NH3(g)△H=-93kJ•mol-1.试根据表中所列键能数据计算a 的数值:+391 kJ•mol-1.
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.(1)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1452.8kJ/mol.
(2)如图是某笔记本电脑用甲醇燃料电池的结构示意图.放电时甲醇应从a处通入(填“a”或“b”),电池内部H+向右(填“左”或“右”)移动.写出电池负极的电极反应式:CH3OH-6e-+H2O=CO2+6H+.
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+O2(g)=CO2(g)△H1=-393.5kJ•mol-1
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ•mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ•mol-1
根据盖斯定律,计算2C(s,石墨)+H2(g)=C2H2(g)反应的焓变△H=+226.7kJ•mol-1.
12.4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为15,W的最高价与最低价代数和为0,Y是同周期元素中离子半径最小的,Y、Z原子序数之差为4,下列说法不正确的是( )
| A. | X是短周期元素中原子半径最大的 | |
| B. | X元素最高价氧化物对应的水化物,可以与其他三种元素最高价氧化物对应的水化物反应 | |
| C. | WZ4分子中每个原子最外层均达到8电子结构 | |
| D. | X元素的氧化物中只存在离子键 |

 (增塑剂)②
(增塑剂)② (合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂)
(合成橡胶原料)③CH3CH2CH2CH2OH(萃取剂) 香料)
香料) (植物生长刺激素)
(植物生长刺激素)