题目内容
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,Q的各级电离能如下表,W与R是同族元素.
回答下列有关问题:
(1)W原子的价电子排布图为 .
(2)化合物X2W2的电子式 ,化合物XYZ的结构式 .
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是 (写分子式),原因是 .
(4)RW3分子中的键角 ,RW32-分子的立体构型为
(5)X、Z、W、三种元素所形成的常见离子化合物的化学式为 YW2中的化学键类型为 共价键(填“极性”或“非极性”),根据等电子原理,指出与YW互为等电子体且含有Z原子的微粒有 (要求写一种即可).
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
(1)W原子的价电子排布图为
(2)化合物X2W2的电子式
(3)相同条件下,YW2、RW2两者在水中的溶解度较大的是
(4)RW3分子中的键角
(5)X、Z、W、三种元素所形成的常见离子化合物的化学式为
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,则Z为第VA族元素,Z元素之后还有三种比其原子序数大的短周期主族元素,则Z是N元素;
Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,则X、Y、Z、W都是非金属元素,Y位于第IVA族、W位于第VIA族,X为H元素,Y原子序数小于Z,则Y是C元素;
W位于第VIA族且W后还有两种大于其原子序数的短周期主族元素,所以W是O元素;
W与R是同族元素,则R是S元素;
根据Q的各级电离能知,Q第一电离能和第二电离能相差较大,则Q为第IA族元素,且原子序数大于O,所以为Na元素,
再结合题目解答.
Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,则X、Y、Z、W都是非金属元素,Y位于第IVA族、W位于第VIA族,X为H元素,Y原子序数小于Z,则Y是C元素;
W位于第VIA族且W后还有两种大于其原子序数的短周期主族元素,所以W是O元素;
W与R是同族元素,则R是S元素;
根据Q的各级电离能知,Q第一电离能和第二电离能相差较大,则Q为第IA族元素,且原子序数大于O,所以为Na元素,
再结合题目解答.
解答:
解:X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,则Z为第VA族元素,Z元素之后还有三种比其原子序数大的短周期主族元素,则Z是N元素;
Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,则X、Y、Z、W都是非金属元素,Y位于第IVA族、W位于第VIA族,X为H元素,Y原子序数小于Z,则Y是C元素;
W位于第VIA族且W后还有两种大于其原子序数的短周期主族元素,所以W是O元素;
W与R是同族元素,则R是S元素;
根据Q的各级电离能知,Q第一电离能和第二电离能相差较大,则Q为第IA族元素,且原子序数大于O,所以为Na元素,
(1)W是O元素,O原子价电子为其最外层电子,则W原子的价电子排布图为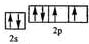 ,故答案为:
,故答案为: ;
;
(2)化合物H2O2中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水电子式为 ,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,
,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,
故答案为: ;H-C≡N;
;H-C≡N;
(3)相同条件下,CO2、SO2两者在水中的溶解度较大的是SO2,原因是二氧化碳是直线形分子为非极性分子,二氧化硫属于V形分子为极性分子,根据相似相溶原理知,二氧化硫易溶于水,故答案为:SO2;二氧化碳是非极性分子,二氧化硫和水都是极性分子;
(4)SO3分子价层电子对个数=3+
×(6-3×2)=3且不含孤电子对,所以为平面三角形结构,则三氧化硫分子中的键角60°,SO32-分子中价层电子对个数=3+
×(6+2-3×2)=4且含有一个孤电子对,所以亚硫酸根离子的立体构型为三角锥形,故答案为:60°;三角锥形;
(5)H、N、O、三种元素所形成的常见离子化合物的化学式为NH4NO3,CO2中的化学键类型为极性共价键,根据等电子原理,指出与CO互为等电子体且含有Z原子的微粒有N2,
故答案为:NH4NO3;极性;N2.
Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形,则X、Y、Z、W都是非金属元素,Y位于第IVA族、W位于第VIA族,X为H元素,Y原子序数小于Z,则Y是C元素;
W位于第VIA族且W后还有两种大于其原子序数的短周期主族元素,所以W是O元素;
W与R是同族元素,则R是S元素;
根据Q的各级电离能知,Q第一电离能和第二电离能相差较大,则Q为第IA族元素,且原子序数大于O,所以为Na元素,
(1)W是O元素,O原子价电子为其最外层电子,则W原子的价电子排布图为
 ,故答案为:
,故答案为: ;
;(2)化合物H2O2中H原子和O原子之间共用一对电子、O原子之间共用一对电子,所以双氧水电子式为
 ,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,
,化合物HCN中C原子和N原子共用3对电子、H原子和C原子共用1对电子,所以HCN的结构式H-C≡N,故答案为:
 ;H-C≡N;
;H-C≡N;(3)相同条件下,CO2、SO2两者在水中的溶解度较大的是SO2,原因是二氧化碳是直线形分子为非极性分子,二氧化硫属于V形分子为极性分子,根据相似相溶原理知,二氧化硫易溶于水,故答案为:SO2;二氧化碳是非极性分子,二氧化硫和水都是极性分子;
(4)SO3分子价层电子对个数=3+
| 1 |
| 2 |
| 1 |
| 2 |
(5)H、N、O、三种元素所形成的常见离子化合物的化学式为NH4NO3,CO2中的化学键类型为极性共价键,根据等电子原理,指出与CO互为等电子体且含有Z原子的微粒有N2,
故答案为:NH4NO3;极性;N2.
点评:本题考查位置结构性质的相互关系及应用,涉及等电子体、微粒空间构型判断、原子杂化方式判断、电子式等知识点,这些知识点都是高考高频点,会利用价层电子对互斥理论确定微粒空间构型、原子杂化方式,题目难度中等.

练习册系列答案
相关题目
下列实验中,有沉淀产生,且沉淀不会消失的是( )
| A、将氨水逐滴滴入AgNO3溶液中,至过量 |
| B、将二氧化碳通入Ca(OH)2 溶液中,至过量 |
| C、将氯气通入AgNO3溶液中好,至过量 |
| D、将二氧化氮通入Ba(OH)2 溶液中,至过量 |
某有机物的结构简式为 ,下列叙述中,正确的是( )
,下列叙述中,正确的是( )
 ,下列叙述中,正确的是( )
,下列叙述中,正确的是( )| A、该有机物的分子式为C11H13O3Cl |
| B、1mol该有机物最多可消耗2molNaOH |
| C、该有机物既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色 |
| D、该有机物中所有原子一定在同一平面内 |
Al粉投入某无色澄清的溶液中产生H2,则下列离子组合正确的是( )
| A、H+、Ca2+、Na+、CO32- |
| B、Mg2+、Al3+、SO42-、Cl- |
| C、Cu2+、Mg2+、Cl-、OH- |
| D、K+、Na+、OH-、SO42- |
下列离子方式书写正确的是( )
| A、NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
| B、向稀Fe(NO3)2和NaBr混合溶液中滴加稀盐酸6Br-+8H++2NO3-=3Br2+2NO↑+4H2O |
| C、Na2S溶液中滴加NaClO溶液:S2-+ClO-+H2O=S↓+Cl-+2OH- |
| D、双氧水使酸性KMnO4溶液褪色2MnO4-+5H2O2=2Mn2++5O2↑+6OH-+2H2O |
关于物质的分离提纯,说法错误的是( )
| A、蒸发操作可以从溶液中分离得到可溶性固体溶质 |
| B、将待过滤的液体直接倒入漏斗中,且使液面低于滤纸边缘 |
| C、可以使用分液的方法分离植物油和水的混合物,植物油从分液漏斗上口倒出 |
| D、蒸馏操作时,温度计的水银球不能伸入液面以下,应在蒸馏烧瓶的支管口处 |
2005年度诺贝尔生理学或医学奖授予巴里?马歇尔和罗宾?沃伦,以表彰他们发现了幽门螺杆菌以及该细菌对消化性溃疡病的致病机理.下列物质适合胃溃疡严重的病人使用的是( )
| A、胃舒平[主要成分是Al(OH)3] |
| B、苏打(主要成分是Na2CO3) |
| C、小苏打(主要成分是NaHCO3) |
| D、碳酸钡粉末 |

 某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空:
某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,完成以下填空: