题目内容
18.有关下列四个常用电化学装置的叙述中,不正确的是( ) |  |  |  |
| 图Ⅰ碱性锌锰电池 | 图Ⅱ铅硫酸蓄电池 | 图Ⅲ电解精炼铜 | 图Ⅳ银锌纽扣电池 |
| A. | 图Ⅰ所示装置中,MnO2是正极,工作时其还原产物是MnOOH | |
| B. | 图Ⅱ所示装置充电过程中,阴极的电极反应式为PbSO4(s)+2e-=Pb(s)+SO42-(aq) | |
| C. | 图Ⅲ所示装置工作过程中,电解质溶液中Cu2+ 浓度始终不变 | |
| D. | 图Ⅳ所示电池中,工作时OH-移向锌电极 |
分析 A.正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O═MnO(OH)+OH-;
B.电池充电过程中,阴极上硫酸铅得电子生成铅;
C.在铜的精炼中,阳极上溶解的铜质量小于阴极上析出铜的质量;
D.Zn失电子作负极,原电池工作时阴离子移向负极.
解答 解:A.正极上二氧化锰得电子发生还原反应,电极反应式为MnO2+e-+H2O═MnO(OH)+OH-,MnOOH为还原产物,故A正确;
B.电池充电过程中,阴极上硫酸铅得电子生成铅,电极反应式为PbSO4(s)+2e-=Pb(s)+SO42-(aq),故B正确;
C.在铜的精炼中,阳极上不仅铜失电子还有其它金属失电子,阴极上只有铜离子得电子,当转移电子相等时,阴极上析出铜的质量大于阳极上溶解铜的质量,所以溶液中铜离子浓度减小,故C错误;
D.Zn失电子作负极,原电池工作时阴离子移向负极,故D正确;
故选C.
点评 本题考查原电池和电解池原理,侧重于学生的分析能力的考查,明确电极上发生的反应是解本题关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.下列说法正确的是( )
| A. | 根据物质的组成和性质特点,可以将物质分成混合物和纯净物,漂白粉、钢、水玻璃、液氨都为混合物 | |
| B. | 氨基酸、蛋白质、油脂、火棉中都含有C、H、O、N四种元素 | |
| C. | 李比希法可用于有机化合物组成中碳、氢元素质量分数的测定,同位素示踪法可用于研究化学反应历程机理 | |
| D. | 大豆蛋白、鸡蛋白分别溶于水所形成的分散系为胶体,在热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质的性质都会改变并发生变性 |
13.无机化合物可根据其组成和性质进行分类:
(1)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在上表中②③⑥后面.
(2)写出⑦转化为⑤的化学方程式2NaOH+CO2=Na2CO3+H2O.
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl ②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
(2)写出⑦转化为⑤的化学方程式2NaOH+CO2=Na2CO3+H2O.
3.下列有关氢化物的叙述中正确的是( )
| A. | 稳定性:H2S>HF | B. | HCl的电子式: | ||
| C. | 在卤化氢中HI最稳定 | D. | 沸点:PH3>NH3 |
10.下列化学措施不可行的是( )
| A. | 以CH≡CH 和HCl 反应制氯乙烯,进而制备聚氯乙烯塑料 | |
| B. | 浓氨水滴入生石灰中,将产生的气体通入AlCl3溶液,可得到含AlO2-的溶液 | |
| C. | 使用催化剂不能改变工业合成NH3的反应限度 | |
| D. | 用浸有KMnO4溶液的硅土来吸收水果释放的乙烯 |
7.垃圾应分类处理,导致“白色污染”的生活垃圾应放置于贴有a(填字母)标志的垃圾桶中.

为治理“白色污染”,有人提出把塑料垃圾集中,然后集中在露天焚烧,这种处理方法的弊端是造成资源浪费(写出其中一种).

为治理“白色污染”,有人提出把塑料垃圾集中,然后集中在露天焚烧,这种处理方法的弊端是造成资源浪费(写出其中一种).
8.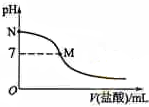 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
 298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )
298K时,在20.0mL 0.10mol•L-1氨水中滴入0.10mol•L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示.已知0.10mol•L-1氨水的电离度为1.32%,下列有关叙述正确的是( )| A. | 该滴定过程应该选择石蕊作为指示剂 | |
| B. | M点对应的盐酸体积为20.0 mL | |
| C. | M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-) | |
| D. | N点处的溶液中pH<12 |