题目内容
13.下列溶液中Cl-物质的量浓度最大的是( )| A. | 10mL 0.1mol/L的FeCl3溶液 | B. | 20mL 0.1mol/L的MgCl2溶液 | ||
| C. | 30mL 0.2mol/L的KCl溶液 | D. | 100mL 0.25mol/L的HCl溶液 |
分析 根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数,与溶液的体积无关.
解答 解:A、10mL 0.1mol•L-1FeCl3溶液中C(Cl-)=3C(FeCl3)=0.1mol/L×3=0.3mol/L;
B、20mL 0.1mol•L-1MgCl2溶液中C(Cl-)=2C(MgCl2)=0.1mol/L×2=0.2mol/L;
C、430mL 0.2mol•L-1KCl溶液中C(Cl-)=C(KCl)=0.2mol/L;
D、100mL 0.25mol•L-1HCl溶液中C(Cl-)=C(HCl)=0.25mol/L;
所以氯离子浓度最大的是0.3mol/L;
故选A.
点评 本题考查了物质的量浓度的有关计算,根据溶液中C(Cl-)=溶质的物质的量浓度×化学式中氯离子个数来解答即可,题目难度不大.

练习册系列答案
相关题目
6.下列对化学反应的认识不正确的是( )
| A. | 会引起化学键的变化 | B. | 必然引起物质状态的变化 | ||
| C. | 必然伴随着能量的变化 | D. | 会产生新的物质 |
1.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 常温常压下,23gNO2含有NA个氧原子 | |
| B. | 常温常压下,18mLH2O约含有NA个H2O分子 | |
| C. | 含14 NA个电子的N2分子的物质的量是1mol | |
| D. | 0.1mol/L的Ba(OH)2溶液中,OH-的个数为0.2NA个 |
18.120℃,101kPa下,将下列烃的混合物分别与足量的氧气混合,引燃反应后,恢复到原来的温度,气体体积一定不变的是( )
| A. | C2H6 C2H4 C2H2 | B. | C2H4 C3H6 | C. | C3H8 C3H6 | D. | CH4 C2H4 C3H4 |
5.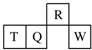 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 原子半径:T>Q>R | |
| D. | T的非金属性强于Q的非金属性 |
2.通常情况下,下列液体饮料的pH<7的是( )
| A. | 苏打水 | B. | 白酒 | C. | 柠檬汁 | D. | 纯净水 |
3.如图为A、B、C三种物质的溶解度曲线,请据图判断下列叙述中不正确的是( )


| A. | t1℃时,B物质的溶解度为40g | |
| B. | 要将C的不饱和溶液转化为饱和溶液可以采取降温的方法 | |
| C. | t2℃时,三种物质的溶解度由大到小的顺序为:A>B>C | |
| D. | 将t2℃时A、B的饱和溶液降温到t1℃时,析出的晶体A比B多 |
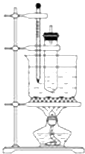 苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下:
苯与浓硝酸的反应:实验室制备硝基苯的实验装置如下图所示,主要步骤如下: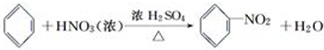 .
.
 .
.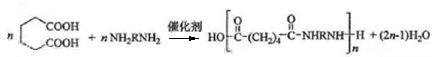 .
.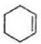 $\stackrel{溴的四氯化碳溶液}{→}$
$\stackrel{溴的四氯化碳溶液}{→}$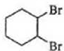 $→_{△}^{氢氧化钠/醇}$
$→_{△}^{氢氧化钠/醇}$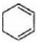 .
.