题目内容
1.下列递变规律正确的是( )| A. | 钠、镁、铝的还原性依次减弱 | |
| B. | NaOH、Mg(OH)2、Al(OH)3碱性依次增强 | |
| C. | HCl、HBr、HI的稳定性依次增强 | |
| D. | HClO4、H2SO4、H3PO4的酸性依次增强 |
分析 A.元素的金属性越强,其单质还原性越强;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:A.元素的金属性越强,其单质还原性越强,金属性Na>Mg>Al,所以钠、镁、铝的还原性依次减弱,故A正确;
B.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性Na>Mg>Al,所以NaOH、Mg(OH)2、Al(OH)3碱性依次减弱,故B错误;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性Cl>Br>I,所以HCl、HBr、HI的稳定性依次减弱,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>P,所以HClO4、H2SO4、H3PO4的酸性依次减弱,故D错误;
故选A.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和元素周期律关系是解本题关键,知道非金属性、金属性强弱比较方法,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
12.关于下列水溶液的说法正确的是( )
| A. | HNO3溶液中无OH- | |
| B. | 常温下,任何物质的水溶液中都有H+和OH-,且KW=10-14 | |
| C. | NaCl溶液中既无OH-也无H+ | |
| D. | 氢氧化钠溶液中无H+ |
6.若某阴离子的结构示意图如图所示,则该元素在元素周期表中的位置可能是( )
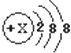
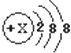
| A. | 第四周期IA | B. | 第三周期0族 | C. | 第二周期VIIA | D. | 第三周期VIIA族 |
13.按碳骨架分类,下列说法正确的是( )
| A. |  属于醇类化合物 属于醇类化合物 | B. |  属于芳香族化合物 属于芳香族化合物 | ||
| C. | CH 3CH(CH 3 )2 属于链状化合物 | D. |  属于脂环化合物 属于脂环化合物 |
10.Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
(1)写出上述实验中发生反应的化学方程式:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的反应速率最慢的是C.
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).
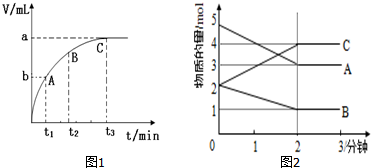
(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数37.5%.
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
(2)实验结果表明,催化剂的催化效果与催化剂的表面积有关.
(3)某同学在10mL H2O2 溶液中加入一定量的二氧化锰,放出气体的体积(标准状况)与反应时间的关系如图1所示,则A、B、C三点所表示的反应速率最慢的是C.
Ⅱ.某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图2所示(A,B,C均为气体,且A气体有颜色).

(4)该反应的化学方程式为2A+B?2C.
(5)反应开始至2分钟时,B的平均反应速率为0.1mol/(L•min).
(6)能说明该反应已达到平衡状态的是cd.
a.v(A)=2v(B)
b.容器内各物质的物质的量相等
c.v逆(A)=v正(C)
d.容器内气体的颜色保持不变
(7)由图求得平衡时A的体积分数37.5%.
 (1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol
(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料.已知在101kPa,320g N2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧的热化学方程式是:N2H4(l)+O2(g)=N2(g)+2H2O(l)△H=-62.4KJ/mol