题目内容
已知次氯酸分子的结构式为H-O-Cl,下列有关说法正确的是( )
| A、次氯酸为非极性共价化合物 |
| B、O原子与H、Cl都形成σ键 |
| C、该分子为直线型分子 |
| D、该分子的电子式是H:O:Cl |
考点:不同晶体的结构微粒及微粒间作用力的区别,化学键,判断简单分子或离子的构型
专题:
分析:A、HClO是由O-H、O-Cl组成的极性共价化合物;
B、共价单键为σ键;
C、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
D、次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构.
B、共价单键为σ键;
C、HClO中O的价层电子对数为4,孤电子对数为2,空间构型为V型;
D、次氯酸分子为共价化合物,其中氢原子最外层达到2个电子稳定结构,氯、氧原子达到8电子稳定结构.
解答:
解:A、HClO是由O-H、O-Cl组成的极性共价化合物,故A错误;
B、从次氯酸的结构式可以看出含有O-H、O-Cl,共价单键为σ键,故B正确;
C、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故C错误;
D、H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为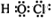 ,故D错误;
,故D错误;
故选B.
B、从次氯酸的结构式可以看出含有O-H、O-Cl,共价单键为σ键,故B正确;
C、HClO中O价层电子对数为4,孤电子对数为2,空间构型为V型,故C错误;
D、H原子最外层1个电子,Cl原子最外层7个电子,O原子最外层6个电子,次氯酸为共价化合物,其电子式为
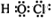 ,故D错误;
,故D错误;故选B.
点评:本题考查了次氯酸分子的结构,明确分子极性、共价键分类、价层电子对互斥理论和电子式的书写是解题的关键,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
下列各物质的电子式书写错误的是( )
A、 |
B、 |
C、 |
D、 |
在不同的化学反应里,既能表现酸性,又能表现氧化性和脱水性的酸是( )
| A、浓H2SO4 |
| B、HNO3 |
| C、HCl |
| D、H2O |
在常温常压下,将a L SO2和b L H2S混合,当反应后气体体积是反应前气体体积的四分之一时,则a与b之比为( )
| A、1:1 | B、1:2 |
| C、1:3 | D、1:4 |
下列说法正确的是( )
| A、c(H+)>1.0×10-71mol?L-1的溶液一定呈酸性 |
| B、c(H+)?c(OH-)=1.0×10-14的溶液一定呈中性 |
| C、中性溶液中的c(H+)一定等于1.0×10-71mol?L-1 |
| D、c(H+)=c(OH-)的溶液一定是中性溶液 |
 如图,先向B中充入2molX、2molY,关闭活塞K,再向A充入1molX、1molY,使起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错误的是( )
如图,先向B中充入2molX、2molY,关闭活塞K,再向A充入1molX、1molY,使起始时A、B的体积相等都等于a L,在相同温度和催化剂存在的条件下,两容器中各自发生下述反应,X(g)+Y(g)?2Z(g)+W(g); A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法错误的是( )| A、反应速率:v(B)>v(A) |
| B、A容器中X的转化率为 80% |
| C、A中混合气体密度不再变化能够证明 A中反应达到平衡状态 |
| D、B中混合气体密度不再变化能够证明 B中反应达到平衡状态 |

