题目内容
Ⅰ.(1)配平该反应并标出电子转移的方向和数目:KMnO4+HCl═MnCl2+KCl+Cl2↑+H2O
(2)氧化剂是 ,氧化产物是 (填化学式).
(3)若生成71g Cl2消耗的HCl是 ,被氧化的HCl是 .
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1mol CS2在1mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为 L.
Ⅱ.(1)下列A.B.C.D 是中学常见的混合物分离或提纯的基本装置

请根据实验需要将A.B.C.D装置填入适当的空格中.
①分离汽油和氯化钠溶液 ②用自来水制取蒸馏水 ③除去粗盐溶液中悬浮的泥沙
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是 ,发生反应的离子方程式 .
(2)氧化剂是
(3)若生成71g Cl2消耗的HCl是
(4)CS2(液体)能在O2中完全燃烧,生成CO2和SO2,若将0.1mol CS2在1mol O2中完全燃烧,所得混合气体在标准状况下所占的体积为
Ⅱ.(1)下列A.B.C.D 是中学常见的混合物分离或提纯的基本装置

请根据实验需要将A.B.C.D装置填入适当的空格中.
①分离汽油和氯化钠溶液
(2)检验Fe3+常用的试剂除碱外,还可以将KSCN溶液滴入待检测溶液中,其产生的现象是
考点:氧化还原反应,化学方程式的有关计算,物质的分离、提纯和除杂
专题:实验评价题,氧化还原反应专题,元素及其化合物
分析:I.(1)~(3)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,由电子守恒和原子守恒可知反应为2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,该反应转移10e-,以此来解答;
(4)二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2,依据反应前后气体体积的变化计算判断;
II.(1)①汽油和氯化钠溶液分层;
②自来水制取蒸馏水,利用沸点不同;
③泥沙不溶于水,食盐溶于水;
(2)Fe3+遇KSCN溶液变为血红色,结合生成络离子.
(4)二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2,依据反应前后气体体积的变化计算判断;
II.(1)①汽油和氯化钠溶液分层;
②自来水制取蒸馏水,利用沸点不同;
③泥沙不溶于水,食盐溶于水;
(2)Fe3+遇KSCN溶液变为血红色,结合生成络离子.
解答:
解:Ⅰ.(1)Mn元素的化合价由+7价降低为+2价,Cl元素的化合价由-1价升高为0,由电子守恒和原子守恒可知反应为2KMnO4+16HCl═2MnCl2+5Cl2↑+8H2O+2KCl中,该反应转移10e-,双线桥标出电子的转移方向和数目为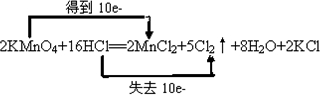 ,
,
故答案为: ;
;
(2)Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则Cl2为氧化产物,故答案为:KMnO4;Cl2;
(3)由反应可知,生成5molCl2消耗16molHCl,则生成71gCl2消耗的HCl是
×
=3.2mol,被氧化的HCl是3.2mol×
=2mol,故答案为:3.2mol;2mol;
(4)二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2,二硫化碳(CS2)是液体,反应前后气体体积不变,所以反应后的气体体积为氧气的体积,则为1mol×22.4L/mol=22.4L,故答案为:22.4;
II.(1)①汽油和氯化钠溶液分层,则选C装置分液来分离,故答案为:C;
②自来水制取蒸馏水,利用沸点不同,则选D装置蒸馏来分离,故答案为:D;
③泥沙不溶于水,食盐溶于水,则选A装置过滤分离,故答案为:A;
(2)Fe3+加KSCN溶液,观察到溶于变为血红色,离子反应为,故答案为:溶液变为血红色;Fe3++3SCN-=Fe(SCN)3.
 ,
,故答案为:
 ;
;(2)Mn元素的化合价降低,则KMnO4为氧化剂,Cl元素的化合价升高,被氧化,则Cl2为氧化产物,故答案为:KMnO4;Cl2;
(3)由反应可知,生成5molCl2消耗16molHCl,则生成71gCl2消耗的HCl是
| 71g |
| 71g/mol |
| 16 |
| 5 |
| 10 |
| 16 |
(4)二硫化碳(CS2)能够在氧气中完全燃烧生成CO2和SO2,反应的化学方程式为:CS2+3O2=CO2+2SO2,二硫化碳(CS2)是液体,反应前后气体体积不变,所以反应后的气体体积为氧气的体积,则为1mol×22.4L/mol=22.4L,故答案为:22.4;
II.(1)①汽油和氯化钠溶液分层,则选C装置分液来分离,故答案为:C;
②自来水制取蒸馏水,利用沸点不同,则选D装置蒸馏来分离,故答案为:D;
③泥沙不溶于水,食盐溶于水,则选A装置过滤分离,故答案为:A;
(2)Fe3+加KSCN溶液,观察到溶于变为血红色,离子反应为,故答案为:溶液变为血红色;Fe3++3SCN-=Fe(SCN)3.
点评:本题考查氧化还原反应,为高频考点,把握发生的氧化还原反应及反应中元素的化合价变化为解答的关键,侧重分析与知识综合应用能力的考查,题目难度不大.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
下列实验操作中,正确的是( )
| A、用剩的药品不要乱丢,要放回原试剂瓶里 | ||
B、给试管里的液体加热,液体的体积一般不超过试管容积的
| ||
| C、加热后的蒸发皿,要用坩埚钳夹取 | ||
| D、用托盘天平称取5.85gNaCl固体,配制100mL1.00mol/L的NaCl溶液 |
下列有关说法正确的是( )
| A、金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物 |
| B、电离、电解均有化学键的破坏过程,因此均属于化学变化 |
| C、常温下干燥的液氯可以用钢瓶储存,所以任何条件下Cl2与铁都不反应 |
| D、葡萄糖溶液和淀粉溶液的本质区别是能否发生丁达尔效应 |
 常温下,向10mL 0.1mol?L-1的H2C2O4溶液中逐滴加入0.1mol?L-1 KOH溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1的H2C2O4溶液中逐滴加入0.1mol?L-1 KOH溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、KHC2O4溶液呈弱碱性 |
| B、B点时:c(K+)>c(HC2O4-)>c(H+)>c(OH-) |
| C、C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) |
| D、D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: C.
C. D.
D.