题目内容
短周期主族元素X、Y、Z、W的原子序数依次增大.X与W同主族,X、W的单质在标准状况下的状态不同.Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构.下列说法正确的是( )
| A、原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、元素Y的简单气态氢化物的热稳定性比Z的强 |
| C、由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性 |
| D、化合物X2Z2与W2Z2所含化学键类型完全相同 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:短周期主族元素X、Y、Z、W的原子序数依次增大,Y是空气中含量最高的元素,则Y为N元素;Z原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Z2-与W+具有相同的电子层结构,则W为Na;X与W同主族,X、W的单质在标准状况下的状态不同,则X单质为气体,故X为H元素,据此解答.
解答:
解:短周期主族元素X、Y、Z、W的原子序数依次增大,Y是空气中含量最高的元素,则Y为N元素;Z原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,则Z为O元素;Z2-与W+具有相同的电子层结构,则W为Na;X与W同主族,X、W的单质在标准状况下的状态不同,则X单质为气体,故X为H元素,
A.同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,氢原子比较最小,故原子半径r(Na)>r(N)>r(O)>r(H),故A错误;
B.非金属性Z(O)>Y(N),元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于NH3,故B错误;
C.由X(H)、Y(N)、Z(O)三种元素形成的化合物中,一水合氨的水溶液呈碱性,故C正确;
D.化合物H2O2含有共价键,而Na2O2含有共价键、离子键,所含化学键类型不完全相同,故D错误,
故选C.
A.同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,氢原子比较最小,故原子半径r(Na)>r(N)>r(O)>r(H),故A错误;
B.非金属性Z(O)>Y(N),元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于NH3,故B错误;
C.由X(H)、Y(N)、Z(O)三种元素形成的化合物中,一水合氨的水溶液呈碱性,故C正确;
D.化合物H2O2含有共价键,而Na2O2含有共价键、离子键,所含化学键类型不完全相同,故D错误,
故选C.
点评:本题考查结构性质位置关系综合应用,推断元素是解题关键,注意对你元素周期律的理解掌握,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
恒温条件下,将NO2装入带活塞的密闭容器中,当反应2NO2(g)?N2O4(g)达到平衡后,慢慢压缩气体体积,下列叙述正确的是( )
| A、若体积减小一半,则压强为原来的两倍 |
| B、平衡向右移动,混合气体颜色一定会变浅 |
| C、若体积减小一半,压强增大,但小于原来的两倍 |
| D、平衡向右移动,混合气体密度减小 |
室温下,下列溶液中粒子的物质的量浓度关系正确的是( )
| A、O.lmol/L NaHS溶液:c(H+)+c(Na+)=c(S2-)+c(HS-)+c(0H-) |
| B、O.lmol/L Na2C03溶液:c(H2CO3)+c(HCO3-)+c(CO32-)=0.lmol/L |
| C、pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合:c(Na+)=c(CH3COO-)>c(OH-)=c(H+) |
| D、浓度均为0.1 mol/L的①NH4Cl②NH4Al(SO4)2③NH4HCO3三种溶液,其中c(NH4+):③>①>② |
下列关于氯的说法错误的是( )
| A、氯水、液氯中均含有Cl2分子,故两者均为黄绿色 | ||||
B、
| ||||
| C、Cl2可以使湿润的有色布条褪色,是因为Cl2有漂白性 | ||||
| D、氯水中分子由多到少的顺序是:H2O>Cl2>HClO |
实验室里不同化学试剂的保存方法不尽相同,①NaOH溶液 ②大理石 ③NaCl溶液 ④稀硝酸4种试剂通常各自存放在如下图所示的玻璃试剂瓶中.按照试剂瓶的顺序存放试剂序号正确的是( )


| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |
下列物质属于羧酸的是( )
| A、HCHO |
| B、CH3COOH |
| C、CH3CH2OH |
| D、CH3COOC2H5 |
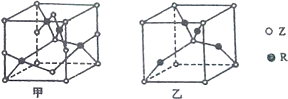 已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题:
已知元素W、X、Y、Z、R为前四周期元素,且原子序数依次增大.元素W的负一价阴离子与某惰性气体结构相同,X是形成化合物种类最多的元素,Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态.请回答下列问题: