题目内容
下列有关物质应用的说法错误的是( )
| A、生石灰用作食品抗氧剂 |
| B、氢氧化铝用于制胃酸中和剂 |
| C、浓氨水可检验氯气管道泄漏 |
| D、氧化铁能用于制作红色涂料 |
考点:常见的食品添加剂的组成、性质和作用,氨的用途,铁的氧化物和氢氧化物,微量元素对人体健康的重要作用
专题:
分析:A、生石灰用作食品干燥剂;
B、氢氧化铝具有弱碱性,能中和酸;
C、氨气和氯气可发生氧化还原反应;
D、氧化铁俗称铁红.
B、氢氧化铝具有弱碱性,能中和酸;
C、氨气和氯气可发生氧化还原反应;
D、氧化铁俗称铁红.
解答:
解:A、生石灰易吸水,能用作食品干燥剂,故A错误;
B、胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,故B正确;
C、氨气和氯气可发生氧化还原反应,生成氮气和氯化铵,有白烟,可用于检验,故C正确;
D、氧化铁为红褐色,俗称铁红,能用作红色染料,故D正确.
故选A.
B、胃酸的主要成分是HCl,氢氧化铝具有弱碱性,能中和酸,故B正确;
C、氨气和氯气可发生氧化还原反应,生成氮气和氯化铵,有白烟,可用于检验,故C正确;
D、氧化铁为红褐色,俗称铁红,能用作红色染料,故D正确.
故选A.
点评:本题考查较为综合,多角度考查元素化合物知识,为高考常见题型,侧重于化学与生活、产生的考查,有利于培养学生良好的科学素养,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;④0.01mol/L NaOH溶液.下列说法正确的是( )
| A、四份溶液中水的电离程度由大到小的顺序为:①=②=④<③ |
| B、若将②、③等体积混合,则混合液的pH为7 |
| C、将四份溶液稀释相同倍数后,溶液的pH:③>④>②>① |
| D、若在10mL①中加入④至pH刚好等于7,则C(Na+)=C(CH3COO-),混合溶液总体积<20mL(假设混和溶液体积为酸和碱溶液体积之和) |
下列电池工作时能量转化形式与其它三个不同的是( )
 |  |  |  |
| A.锌锰碱性电池 | B硅太阳能电池 | C氢燃料电池 | D铅蓄电池 |
| A、A | B、B | C、C | D、D |
相同质量的铜片分别与过量的体积相同的浓硝酸、稀硝酸反应.二者比较,相等的是(溶液体积变化忽略不计)( )
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
①铜片消耗完所需时间;
②反应生成的气体体积(标准状况);
③反应中氧化剂得到的电子总数;
④反应后溶液中铜离子的浓度.
| A、①③ | B、②④ | C、③④ | D、只有① |
下列装置不能完成相应实验的是( )
A、 可用于制备氨气 |
B、 可除去CO2中少量的SO2杂质 |
C、 可用于粗盐提纯 |
D、 可分离CCl4萃取碘水后的分层液体 |
一定条件下存在反应C(s)+H2O(g)═CO(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所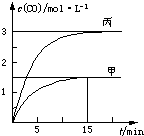 示.下列说法正确的是( )
示.下列说法正确的是( )
H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所
 示.下列说法正确的是( )
示.下列说法正确的是( )| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
| A、甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol?L-1?min-1 |
| B、丙容器的体积V>0.5L |
| C、当温度为T1℃时,反应的平衡常数K=2.25 |
| D、乙容器中,若平衡时n(H2O)=0.4 mol,则T1<T2 |


 为原料制备
为原料制备 的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例如图:CH2=CH2