题目内容
在25℃时,在浓度均为0.1mol?L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为:4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中H+浓度最小的是( )
| A、HNO2 |
| B、HCOOH |
| C、HCN |
| D、H2CO3 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:相同温度下,相同浓度的酸溶液中,酸的电离常数越大,则该酸的酸性越强,酸溶液中氢离子浓度越大.
解答:
解:相同温度相同浓度的酸溶液中,酸的电离常数越大,则该酸的酸性越强,酸溶液中氢离子浓度越大,根据电离平衡常数知,酸的酸性强弱顺序是HNO2>HCOOH>H2CO3>HCN>HCO3-,酸的电离常数越小,则酸中氢离子浓度越小,所以氢离子浓度最小的酸是HCN,
故选C.
故选C.
点评:本题考查了酸性强弱的判断,明确酸性强弱与电离平衡常数的关系是解本题关键,注意酸性越弱的酸其酸根离子的水解程度越大,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
实验是化学研究的基础,关于下列各实验装置图的叙述中,正确的是( )、


| A、溶液上层无色,下层紫红色 |
| B、装置②可用于吸收HCl气体,并防止倒吸 |
| C、装置③可用于制取蒸馏水 |
| D、装置④b口进气可收集H2、CO2等气体 |
海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法,正确的是( )
| A、海水中含有镁元素,只需经过物理变化就可以得到镁单质 |
| B、海水蒸发制海盐的过程中只发生了化学变化 |
| C、从海水中可以得到NaCl,电解NaCl溶液可得到金属钠 |
| D、从海水中提取Br2、I2的过程中发生了氧化还原反应 |
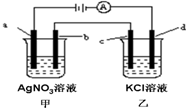 如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )| A、乙烧杯中的d电极反应式为Fe-2e-=Fe2+ |
| B、当电解一段时间后,将甲、乙两溶液混合,一定会沉淀 |
| C、当b极增重5.4g时,d极产生的气体为2.24L(标准状况) |
| D、甲烧杯中溶液的pH降低 |
可逆反应mA(固)+nB(气)?Pc (气)+qD(气)反应过程中其他条件不变时C的百分含量C%与温度(T)和压强(p)的关系如图所示,下列叙述中正确的是( )
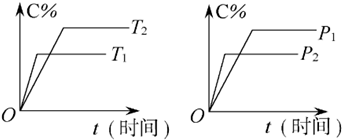

| A、达到平衡后,使用催化剂,C%将增大 |
| B、达到平衡后,若升高温度,化学平衡向逆反应方向移动 |
| C、方程式中n>p+q |
| D、达到平衡后,增加A的量有利于化学平衡向正反应方向移动 |
下列物质与水反应,能放出氧气的是( )
| A、Na |
| B、Na2O |
| C、Na2O2 |
| D、NO2 |
化合反应、分解反应、置换反应和复分解反应是四种基本化学反应类型.下列变化属于氧化还原反应,但是不属于四种基本反应类型的是( )
A、3O2
| ||||
| B、Cu+2FeCl3═CuCl2+2FeCl2 | ||||
C、2Al+Fe2O3
| ||||
| D、2H2O2═2H2O+O2↑ |