题目内容
6.下列说法正确的是( )| A. | 从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 | |
| B. | 蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质 | |
| C. | 硅的性质稳定,所以在自然界中可以以游离态存在 | |
| D. | 电泳现象可证明胶体带电荷 |
分析 A、对化学实验剩余药品,大多是不可以放回原瓶的,但是极少数例外;
B.在水溶液和熔融状态下均不能导电的化合物是非电解质;
C.自然界中没有游离态的硅存在;
D.胶体不带电,胶体粒子带电.
解答 解:A、对化学实验剩余药品,大多是不可以放回原瓶的,但是极少数例外,如金属钠切下一小块后可放回原瓶,故A错误;
B.蔗糖、酒精在水溶液或熔融状态下均不导电属于非电解质,故B正确;
C.硅在自然界中以化合态形式存在.故C错误;
D.胶体不带电,胶体能发生电泳是因为胶体吸附离子而带电,故D错误;
故选B.
点评 本题考查了化学试剂存放、非电解质概念、物质存在形式、胶体性质等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 30g甲醛和醋酸的混合物中含碳原子数目为nA | |
| B. | 22.4LCl2与足量的NaOH溶液反应,转移的电子数为2nA | |
| C. | 100mL0.2mol•L-1AlCl3溶液中,含Al3+数为0.02nA | |
| D. | 25℃,pH=13的NaOH溶液中,OH个数为0.1nA |
17.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 将1 mol BaCl2 溶于水所形成的溶液中含NA个氯离子 | |
| B. | 2克氢气所含原子数约为6.02×1023 | |
| C. | 标准状况下,22.4 L SO2所含的分子数为NA | |
| D. | 常温常压下,22.4 L O2和O3的混合气体所含分子数为2NA |
14.下列物质溶于水能导电,但不属于电解质的是( )
| A. | 过氧化钠 | B. | 蔗糖 | C. | 氯气 | D. | 氯化铁 |
1.设NA为阿伏伽德罗常数的值,下列说法中正确的是( )
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 7.8gNa2O2中含有阴离子数目为0.2NA | |
| C. | 71g氯气溶于水配成溶液,所得溶液中含Cl-数目为1 NA | |
| D. | 4℃,18g水所含分子数目为NA |
11.化学与生活、社会密切相关.下列说法错误的是( )
| A. | 漂白粉在空气中能稳定存在,可用于漂白纸张 | |
| B. | 氢氧化铝具有弱碱性,是医用中常见的胃酸中和剂 | |
| C. | 亚硝酸盐属于食物防腐剂,可以适量地添加于食物中 | |
| D. | 液氨气化时要吸收大量的热,使周围温度降低,因而液氨可作制冷剂 |
16.实验室常用氯化铵与氢氧化钙的固体混合加热制取氨气,实验室提供的有关装置见表:
完成下列填空:
(1)从图中选择实验室制取氨气的发生装置b(选填编号)、收集装置①(选填编号).
(2)用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后注射器内无(选填“有”“无”)气体剩余,液体呈红色,用化学方程式解释液体颜色变化的原因NH3+H2O?NH3•H2O?NH4++OH-.
(3)工业合成氨的简易流程如图:
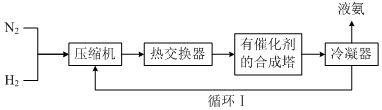
通过循环Ⅰ可利用的气态物质是d
a.催化剂 b.只有N2c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl.29NH3、PH3、
AsH3三种氢化物热稳定性由强到弱的顺序是NH3>PH3>AsH3,理由是N、P、As原子半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性逐渐减弱.
(5)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4.(NH4)2SO4溶液呈酸性,用离子方程式解释原因NH4++H2O=NH3•H2O+H+;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系电荷守恒为:[NH4+]+[H+]=2[SO42-]+[OH-]或者物料守恒为:2[SO42-]=[NH4+]+[NH3•H2O].
| 气体发生装置 | 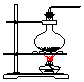 a | 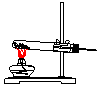 b |  c |
| 气体收集装置 |  2 | 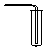 ② | 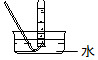 ③ |
(1)从图中选择实验室制取氨气的发生装置b(选填编号)、收集装置①(选填编号).
(2)用注射器收集50mL纯净的氨气,然后再抽取10mL滴有酚酞试液的蒸馏水,并用橡皮塞封闭针头.充分振荡后注射器内无(选填“有”“无”)气体剩余,液体呈红色,用化学方程式解释液体颜色变化的原因NH3+H2O?NH3•H2O?NH4++OH-.
(3)工业合成氨的简易流程如图:

通过循环Ⅰ可利用的气态物质是d
a.催化剂 b.只有N2c.只有H2 d.N2和H2
(4)将 CO2通入到氨化的饱和食盐水中制备NaHCO3固体,反应的化学方程式NaCl+CO2+NH3+H2O→NaHCO3↓+NH4Cl.29NH3、PH3、
AsH3三种氢化物热稳定性由强到弱的顺序是NH3>PH3>AsH3,理由是N、P、As原子半径依次增大,使得N-H、P-H、As-H键长依次增长,热稳定性逐渐减弱.
(5)工业上用氨水吸收SO2尾气,最终得到化肥 (NH4)2SO4.(NH4)2SO4溶液呈酸性,用离子方程式解释原因NH4++H2O=NH3•H2O+H+;该溶液中存在多种守恒,用离子浓度表示其中一种守恒关系电荷守恒为:[NH4+]+[H+]=2[SO42-]+[OH-]或者物料守恒为:2[SO42-]=[NH4+]+[NH3•H2O].
17.由苯和乙醛组成的混合液体,经测定其中碳的质量分数为72%,则混合物中氧元素的质量分数为( )
| A. | 2.14% | B. | 19.56% | C. | 22.65% | D. | 32.00% |