题目内容
一个体重50kg的健康人含铁元素2g。这2g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+ Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
(2)测定绿矾(FeSO4·7H2O)产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②判断此滴定实验达到终点的方法是 。
(1)氧化、 还原
(2)①5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
解析试题分析:(1)Fe的化合价升高,所以Fe2+被氧化;Fe3+转化为Fe2+,作氧化剂,则维生素C作还原剂。
(2)MnO4—氧化Fe2+,根据化合价升降法可写出离子方程式;滴定达到终点时,Fe2+完全反应,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
考点:本题考察氧化还原反应和氧化还原滴定及离子方程式的书写。

在反应3S +6KOH=K2SO3 +2K2S +3H2O 中,作还原剂和作氧化剂的硫原子个数比为
| A.1:2 | B.2:1 | C.1:1 | D.3:2 |
将0.15mol Fe3O4完全溶解在足量稀硫酸中,然后加入K2Cr2O7溶液250mL,恰好使溶液中Fe2+全部氧化成Fe3+,Cr2O72-全部转化成Cr3+,则K2Cr2O7溶液的物质的量浓度是
| A.0.05mol/L | B.0.1mol/L | C.0.2mol/L | D.0.3mol/L |
美蓝(主要成分是亚甲蓝)有较强的还原性,可用做亚硝酸盐中毒的解毒剂,已知亚硝酸盐中毒原理是它会使普通血红蛋白中的铁元素由二价变为三价,失去携氧能力,下列有关说法不正确的是
| A.亚硝酸盐有强氧化性 |
| B.普通血红蛋白有较强氧化性 |
| C.亚硝酸盐中毒后,使用美蓝,高铁血红蛋白被还原 |
| D.中毒与解毒过程中都发生了氧化还原反应 |
制取下列物质一定有氧化还原反应发生的是
| A.FeCl3 | B.Si | C.NH3 | D.SO2 |
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
下列过程不涉及氧化还原反应的是
| A.燃放鞭炮 | B.氯化铵和熟石灰混合加热制氨气 |
| C.金属冶炼 | D.浓盐酸和二氧化锰混合加热制氯气 |
由反应:①Tl3++2Ag→Tl++2Ag+;②Fe+Cu2+→Fe2++Cu;③2Ag++Cu→Cu2++2Ag 得出的结论正确的是
| A.氧化性:Ag+>Tl3+>Cu2+>Fe2+ | B.还原性: Fe>Cu>Ag>Tl |
| C.氧化性:Tl 3+>Ag+>Cu 2+>Fe 2+ | D.还原性: Tl +>Ag>Cu>Fe |
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于区域3的是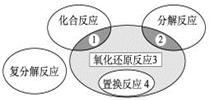
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3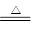 Na2CO3+H2O +CO2↑ Na2CO3+H2O +CO2↑ |
| C.Zn +H2SO4= ZnSO4 + H2↑ |
D.CuO+CO 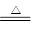 Cu + CO2 Cu + CO2 |