题目内容
下列叙述正确的是
| A.浓硫酸可干燥H2、SO2、NH3等气体 |
| B.久置于空气中的氢氧化钠溶液,加足量盐酸时有气体产生 |
| C.因海水中含有镁元素,故不需经过化学变化就可以得到镁单质 |
| D.足量的硫单质与64g铜反应,有2mol电子发生转移 |
B
解析试题分析:硫酸与氨气反应,所以浓硫酸不能干燥氨气,A项错;久置于空气中的氢氧化钠溶液,与空气中的CO2反应,生成Na2CO3,加足量盐酸又生成CO2,B项正确;海水中含有Mg2+,必修经过化学反应才能得到镁单质。硫与铜反应生成Cu2S,Cu的化合价为+1,64g铜反应,有1mol电子发生转移。
考点:本题考查物质的性质及电子转移。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
下列过程中不涉及氧化还原反应的是( )
| A.由植物油制备人造黄油 |
| B.用氯化铁溶液腐蚀印刷线路板 |
| C.用牺牲阳极的阴极保护法防止金属被腐蚀 |
| D.在蛋白质溶液中加入饱和硫酸铵溶液,析出白色固体 |
钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2 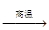 TiCl4+2CO。下列关于该反应的说法正确的是
TiCl4+2CO。下列关于该反应的说法正确的是
| A.TiO2是氧化剂 |
| B.氧化剂与还原剂的物质的量之比为1:1 |
| C.Cl2发生氧化反应 |
| D.当2 mol C参加反应时,转移的电子数目为2 mol |
下列反应中氯元素被氧化的是( )
A.MnO2+4HCl MnCl2+2H2O+Cl2↑ MnCl2+2H2O+Cl2↑ |
| B.2HCl+Ca(OH)2=CaCl2+2H2O |
| C.5Cl2+I2+6H2O=10HCl+2HIO3 |
D.2KClO3 2KCl+3O2↑ 2KCl+3O2↑ |
下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是
| A.纯碱 | B.烧碱 | C.硫酸 | D.硝酸 |
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
 Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。