题目内容
由反应:①Tl3++2Ag→Tl++2Ag+;②Fe+Cu2+→Fe2++Cu;③2Ag++Cu→Cu2++2Ag 得出的结论正确的是
| A.氧化性:Ag+>Tl3+>Cu2+>Fe2+ | B.还原性: Fe>Cu>Ag>Tl |
| C.氧化性:Tl 3+>Ag+>Cu 2+>Fe 2+ | D.还原性: Tl +>Ag>Cu>Fe |
C
解析试题分析:①Tl3++2Ag→Tl++2Ag+;氧化剂Tl3+氧化性大于氧化产物Ag+;还原剂Ag还原性大于还原产物Tl+;②Fe+Cu2+→Fe2++Cu; 氧化剂Cu2+氧化性大于氧化产物Fe2+;还原剂Fe还原性大于还原产物Cu;③2Ag++Cu→Cu2++2Ag 氧化剂Ag+氧化性大于氧化产物Cu2+;还原剂Cu还原性大于还原产物Ag;得到氧化性顺序:Tl3+>Ag+>Cu2+>Fe2+;还原性顺序Fe>Cu>Ag>Tl+;故选C。
考点:本题考查了氧化还原反应强弱规律的分析判断,依据化合价变化判断氧化剂、还原剂、氧化产物、还原产物是解题关键,题目较简单。

 阅读快车系列答案
阅读快车系列答案据报道,科学家发现了如下反应:O2+PtF6→O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价。对于此反应,下列说法正确的是
| A.此反应是非氧化还原反应 |
| B.O2(PtF6) 中氧元素的化合价是+1价 |
| C.在此反应中,O2是氧化剂,PtF6是还原剂 |
| D.此反应中,每生成1mol O2(PtF6)转移1mol 电子 |
下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是
| A.纯碱 | B.烧碱 | C.硫酸 | D.硝酸 |
固体NH5属于离子晶体。它与水反应的化学方程式为:NH5+H2O→NH3·H2O+H2↑,它也能跟乙醇发生类似的反应,并都产生氢气。下列有关NH5叙述正确的是
| A.与水反应时,水作氧化剂 | B.NH5中N元素的化合价为+5价 |
| C.1 mol NH5中含有5NA个N—H键 | D.与乙醇反应时,NH5被还原 |
铋(Bi)位于元素周期表中VA族,其价态为+3时较稳定,铋酸钠(NaBiO3)可氧化硫酸锰(MnSO4),反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO- 4+5Bi3++Na++7H2O,下列说法错误的是
| A.若有0.1mol氧化产物生成,则转移0.5mol电子 |
| B.铋酸钠难溶于水 |
| C.该反应可以用于鉴定Mn2+离子 |
| D.该反应可以用浓盐酸酸化 |
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6)。下列有关该反应的说法正确的是
| A.该反应中Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.反应中每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.反应中氧化产物与还原产物的物质的量之比为2 : 1 |
已知5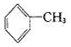 +6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
+6KMnO4+9H2SO4=3K2SO4+6MnSO4+14H2O+_______。
下列说法不正确的是
A.氧化产物为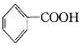 | B. 作氧化剂 作氧化剂 |
| C.每1mol KMnO4转移5mol e- | D.H2SO4起酸的作用 |
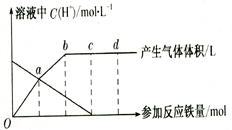
 Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。