题目内容
9.二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义.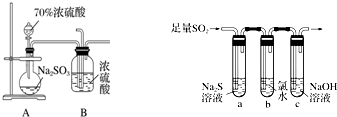
(1)简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加.
某学习小组设计用如图装置验证二氧化硫的化学性质.
(2)能说明二氧化硫具有氧化性的实验现象a试管中有淡黄色沉淀生成.
(3)为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验.
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是Ⅲ(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-.
分析 (1)用分液漏斗向圆底烧瓶中滴加液体,应使分液漏斗和烧瓶内压强相等;
(2)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应;
(3)氯气具有氧化性,可以将二氧化硫氧化到最高价的硫酸.
解答 解(1)分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加;
(2)二氧化硫具有氧化性,可以和最低价的硫化钠发生氧化还原反应,生成淡黄色的沉淀S,故答案为:a试管中有淡黄色沉淀生成;
(3)方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成,可能是氯水中的氯离子产生的作用,
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去,可以是氯水中含有的漂白性物质次氯酸起的作用;
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀,证明溶液中含硫酸根离子,是二氧化硫在酸性环境下被氯水氧化生成的,即SO2+Cl2+2H2O=4H++SO42-+2Cl-,S元素的化合价升高,体现二氧化硫的还原性,则实验设计合理,
故答案为:Ⅲ;SO2+Cl2+2H2O=4H++SO42-+2Cl-.
点评 本题考查二氧化硫的性质及实验设计,为高频考点,把握反应中元素的化合价变化及(2)中实验目的为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
19.下列关于卤素(氟氯溴碘元素,简称为卤素)的叙述正确的是( )
①卤素的钾盐中,所有卤素的化合价均为-1价
②溴中溶有少量氯气,可以用加入溴化钠再用苯萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④某溶液与淀粉KI溶液混合后出现蓝色,则证明该溶液是氯水或溴水
⑤氯气与水溶液反应,一定有酸生成⑥氯气跟水反应时,水既不作氧化剂也不是还原剂.
①卤素的钾盐中,所有卤素的化合价均为-1价
②溴中溶有少量氯气,可以用加入溴化钠再用苯萃取的方法提纯
③溴化银具有感光性,碘化银不具有感光性
④某溶液与淀粉KI溶液混合后出现蓝色,则证明该溶液是氯水或溴水
⑤氯气与水溶液反应,一定有酸生成⑥氯气跟水反应时,水既不作氧化剂也不是还原剂.
| A. | ①③⑤ | B. | ②③⑥ | C. | ②⑤⑥ | D. | ①③④ |
20.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | H2与Cl2混合后点燃与 H2 在Cl2中安静燃烧的反应速率是一样大的 | |
| B. | 反应物所具有的总能量高于产物所具有的总能量 | |
| C. | 断开1mol H-H键和1mol Cl-Cl键所吸收的总能量小于形成1mol H-Cl键所放出的能量 | |
| D. | 该反应中,化学能只转变为热能 |
17.下列推断正确的是( )
| A. | 常温下硅性质活泼,可以与氯气、强酸、强碱溶液等起反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色 |
4.有机化合物中的 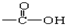 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
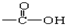 中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )
中的-OH被卤原子取代所得的化合物为酰卤,下列化合物中可以看作酰卤的是( )| A. | HCOOH | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
14.在2L密闭容器中,某气体反应物在2s内由8mol变为7.2mol,则用此反应物表示该反应的平均反应速率为( )
| A. | 0.4 mol•(L•s)-1 | B. | 0.3 mol•(L•s)-1 | C. | 0.2 mol•(L•s)-1 | D. | 0.1 mol•(L•s)-1 |
1.下列关于甲烷的说法正确的是( )
| A. | CH4与Cl2反应生成的四种有机产物常温下都是液体 | |
| B. | CH4、CCl4都是正四面体结构 | |
| C. | CH4是天然气、沼气、水煤气、坑道气的主要成分 | |
| D. | CH4通常情况下性质稳定,但可以和氯水在光照条件下发生反应 |
18.A、B、C为三种短周期元素,A、B在同周期,A、C的最低价离子分别为A2-和C-.B2+和C-具有相同的电子层结构.下列说法中,正确的是( )
| A. | 原子序数B>A>C | B. | 原子半径A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 原子最外层电子数C>A>B |
 L B.
L B. L C.
L C. D .
D . L
L