题目内容
有A、B、C、D 四种化合物,分别由K+、Ba2+、SO42-、CO32-、OH-中的两种组成,它们具有下列性质:①A不溶于水和盐酸;②B不溶于水,但溶于盐酸,并放出无色无刺激性气味的气体E;③C的水溶液呈碱性,与硫酸反应生成A;④D可溶于水,与硫酸作用时放出气体E,E可使澄清石灰水变浑浊.
(1)推断A、B、C、D、E的化学式.
A ;B ;C ;D ;E
(2)写出下列反应的离子方程式.
B与盐酸反应
C与硫酸反应
D与硫酸反应
E(少量)与澄清石灰水反应 .
(1)推断A、B、C、D、E的化学式.
A
(2)写出下列反应的离子方程式.
B与盐酸反应
C与硫酸反应
D与硫酸反应
E(少量)与澄清石灰水反应
考点:无机物的推断,离子方程式的书写
专题:
分析:有A、B、C、D四种化合物,分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-组成,
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,D为K2CO3,以此解答该题.
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,D为K2CO3,以此解答该题.
解答:
解:有A、B、C、D四种化合物,分别由K+、Ba2+、SO42-、CO32-、SO32-、OH-组成,
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,D为K2CO3,
(1)上述推断得到A为BaSO4,B为BaCO3,C为Ba(OH)2 ,D为K2CO3,E为CO2,故答案为:BaSO4;BaCO3;Ba(OH)2;K2CO3;CO2;
(2)B与盐酸反应是BaCO3和盐酸反应生成氯化钡和水,反应的离子方程式为:2H++BaCO3=CO2↑+H2O+Ba2+,
C和硫酸反应是Ba(OH)2和硫酸反应生成硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
D与硫酸反应是K2CO3和硫酸反应生成二氧化碳和水,反应的离子方程式为:2H++CO32-=CO2↑+H2O,
E(少量)与澄清石灰水反应是CO2和澄清石灰水反应生成碳酸钙和水,反应的离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O,
故答案为:2H++BaCO3=CO2↑+H2O+Ba2+;Ba2++2H++2OH-+SO42-=BaSO4↓+2H2O;2H++CO32-=CO2↑+H2O; Ca2++2OH-+CO2=CaCO3↓+H2O.
①A不溶于水和盐酸,应为硫酸钡;
②B不溶于水但溶于盐酸,并放出无气味的气体,该气体可使澄清石灰水变浑浊,可知是BaCO3;
③C的水溶液呈碱性,与硫酸反应生成A,依据A为BaSO4分析,C为Ba(OH)2;
④D可溶于水,与H2SO4作用时放出气体E,D为K2CO3,
(1)上述推断得到A为BaSO4,B为BaCO3,C为Ba(OH)2 ,D为K2CO3,E为CO2,故答案为:BaSO4;BaCO3;Ba(OH)2;K2CO3;CO2;
(2)B与盐酸反应是BaCO3和盐酸反应生成氯化钡和水,反应的离子方程式为:2H++BaCO3=CO2↑+H2O+Ba2+,
C和硫酸反应是Ba(OH)2和硫酸反应生成硫酸钡和水,反应的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,
D与硫酸反应是K2CO3和硫酸反应生成二氧化碳和水,反应的离子方程式为:2H++CO32-=CO2↑+H2O,
E(少量)与澄清石灰水反应是CO2和澄清石灰水反应生成碳酸钙和水,反应的离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O,
故答案为:2H++BaCO3=CO2↑+H2O+Ba2+;Ba2++2H++2OH-+SO42-=BaSO4↓+2H2O;2H++CO32-=CO2↑+H2O; Ca2++2OH-+CO2=CaCO3↓+H2O.
点评:本题考查了物质推断,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握物质性质和反应现象的分析判断,物质检验实验方法分析,实验过程中反应现象的理解应用,物质和离子性质熟练掌握是解题关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列有关实验的操作及描述不正确的是( )
| A、粗盐提纯时,为了加快过滤速率,可用玻璃棒搅拌过滤器中的液体 |
| B、用托盘天平称取10.5 g NaCl时应在右边托盘中放入10 g砝码 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、测定溶液pH的操作将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,然后与标准比色卡对照 |
下列能够检验出KI中是否含有Br-的实验是( )
| A、加入足量的新制氯水,溶液颜色变深,则含有Br- |
| B、加入KMnO4酸性溶液,溶液颜色褪去,则含有Br- |
| C、加入少量的碘水,再加入CCl4振荡,CCl4层有色,则含有Br- |
| D、加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
下列叙述中不正确的是( )
| A、“氯碱工业”通过电解饱和食盐水生产氯气和烧碱 |
| B、通常状况下,干燥的氯气能和Fe反应 |
| C、纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸 |
| D、新制氯水具有漂白性,久置氯水最终变为稀盐酸 |
某温度下,在一个2L的密闭容器中,加入4mol A和2mol B进行如下反应:3A(g)+2B(g)?4C(?)+2D(?).反应一段时间后达到平衡,测得生成1.6mol C,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是( )
A、该反应的化学平衡常数表达式是K=
| ||
| B、此时,B的平衡转化率是35% | ||
| C、增大该体系的压强,平衡正向移动,化学平衡常数增大 | ||
| D、增加C,B的平衡转化率不变 |
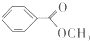 )是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.
)是一种重要的工业有机溶剂.请分析下列有机物的结构简式或性质特点,然后回答问题.