题目内容
3.恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+Y(g)?2Z(g);△H<0.10min 后达平衡,侧得容器内压强是反应前的$\frac{5}{6}$,下列说法中错误的是( )| A. | 平衡时,X 的转化率为50% | |
| B. | 该握度下平衡常数K=10(10mol•L-1)-1 | |
| C. | 10min内生成物Z 的反应速率0.02mol•L-1•min-1 | |
| D. | 若Y是有色气体,只压缩容器的体积,则体系颜色变浅 |
分析 压强之比等于物质的量之比,反应前物质总物质的量为3mol,则反应后物质的量为2.5mol,根据三行式分析解答.
解答 解:A、由反应可知2X(g)+Y(g)?2Z(g),变化量就是Y的物质的量,所以Y的物质的量为3-2.5=0.5mol,所以X的变化量为1mol,则平衡时,X 的转化率为50%,故A正确;
B、2X(g)+Y(g)?2Z(g),
初起量:2mol 1mol 0mol
变化量:1mol 0.5mol 1mol
平衡量:1mol 0.5mol 1mol,
所以K=$\frac{(\frac{1}{5})^{2}}{(\frac{1}{5})^{2}×\frac{0.5}{5}}$=10,故B正确;
C、10min内生成物Z 的反应速率为:$\frac{\frac{1mol}{5L}}{10min}$=0.02mol•L-1•min-1,故C正确;
D、根据平衡移动的原理,只压缩容器的体积,平衡向正反应方向移动,也就是向减弱Y的方向移动,但未抵消,所以浓度比原浓度大,故D错误;
故选D.
点评 本题主要考查了平衡移动的影响因素、反应速率的计算、转化率的计算等知识,难度不大,解题时要注意先根据题意判断出平衡时各组分的物质的量.

练习册系列答案
相关题目
16.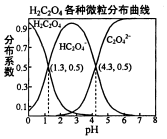 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
 常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )
常温下,0.1mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数〔分布系数)随PH变化的关系如图所示.下列表述不正确的是( )| A. | HC2O4-?H++C2O42-,K=1×10-4.3 | |
| B. | 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液PH恰好为4.3 | |
| C. | 常温下HF的KB=1×10--3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4- | |
| D. | 在0.1mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(OH-) |
3.下列有关实验操作、发生的现象、解释或结论都正确的是( )
| 选项 | 实验操作 | 发生的现象 | 解释或结论 |
| A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解于水的沉淀 |
| B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
| C | 常温下铜片插入硝酸中 | 产生白色沉淀 | 常温下铜和硝酸一定产生NO2 |
| D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
| A. | A | B. | B | C. | C | D. | D |
8.在一密闭容器中,反应aA(g)?bB(g)达到平衡后,保持温度不变,将容器体积扩大一倍,当达到新平衡时B的浓度是原来的60%,则( )
| A. | 平衡向逆反应方向移动 | B. | B的质量分数增加 | ||
| C. | a>b | D. | A的转化率减小 |
15.1mol氨气(化学式为:NH3)分解成氮气和氢气要吸收46.19kJ的热量,下列热化学方程式中正确的是( )
| A. | 2NH3=N2+3H2-46.19kJ | B. | 2NH3(g)=N2(g)+3H2(g)-46.19kJ | ||
| C. | NH3(g)=$\frac{1}{2}{N_2}$(g)+$\frac{3}{2}{H_2}$(g)-46.19kJ | D. | 2NH3(g)=N2(g)+3H2(g)+92.38kJ |
13.乌头酸的结构简式如图所示,下列关于乌头酸的说法错误的是( )
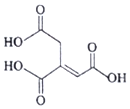

| A. | 化学式为C6H6O6 | |
| B. | 乌头酸含有三种官能团 | |
| C. | 乌头酸能使酸性高锰酸钾溶液褪色 | |
| D. | 含l mol乌头酸的溶液最多可消耗3 mol NaOH |
 实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下:
实验室用间二硝基苯通过催化加氢制备间硝基苯胺的实验步骤如下: