题目内容
下列关于氢硫酸、亚硫酸、硫酸的叙述正确的是( )
| A、它们都是酸,因此彼此不发生反应 |
| B、只有亚硫酸可以露置在空气中,其他酸都不行 |
| C、鉴别三种酸溶液时,只要分别滴入BaCl2溶液即可 |
| D、它们是二元酸,酸性H2S<H2SO3<H2SO4 |
考点:含硫物质的性质及综合应用
专题:氧族元素
分析:A、浓硫酸能与氢硫酸发生氧化还原反应,H2SO4(浓)+H2S=2H2O+S↓+SO2↑,3H2SO4(浓)+H2S
4H2O+4SO2↑;
B、亚硫酸在空气中被氧气氧化为硫酸而变质;
C、三种酸与BaCl2溶液反应生成的BaS、BaCO3、BaSO4均不溶于水;
D、每个H2S、H2SO3、H2SO4分子均是最多电离出2个氢离子,氢硫酸的酸性小于碳酸,亚硫酸的酸性大于碳酸,硫酸的酸性大于亚硫酸.
| ||
B、亚硫酸在空气中被氧气氧化为硫酸而变质;
C、三种酸与BaCl2溶液反应生成的BaS、BaCO3、BaSO4均不溶于水;
D、每个H2S、H2SO3、H2SO4分子均是最多电离出2个氢离子,氢硫酸的酸性小于碳酸,亚硫酸的酸性大于碳酸,硫酸的酸性大于亚硫酸.
解答:
解:A、浓硫酸能与氢硫酸发生氧化还原反应,H2SO4(浓)+H2S=2H2O+S↓+SO2↑,3H2SO4(浓)+H2S
4H2O+4SO2↑,故A错误;
B、亚硫酸在空气中被氧气氧化为硫酸而变质,2H2SO3+O2=2H2SO4,故B错误;
C、三种酸与BaCl2溶液反应生成的BaS、BaCO3、BaSO4均不溶于水,因此无法区分,故C错误;
D、每个H2S、H2SO3、H2SO4分子均是最多电离出2个氢离子,因此都是二元酸,氢硫酸的酸性小于碳酸,亚硫酸的酸性大于碳酸,硫酸的酸性大于亚硫酸,故D正确;
故选D.
| ||
B、亚硫酸在空气中被氧气氧化为硫酸而变质,2H2SO3+O2=2H2SO4,故B错误;
C、三种酸与BaCl2溶液反应生成的BaS、BaCO3、BaSO4均不溶于水,因此无法区分,故C错误;
D、每个H2S、H2SO3、H2SO4分子均是最多电离出2个氢离子,因此都是二元酸,氢硫酸的酸性小于碳酸,亚硫酸的酸性大于碳酸,硫酸的酸性大于亚硫酸,故D正确;
故选D.
点评:本题考查了含硫物质的性质和综合应用,难度一般,掌握含硫物质的性质是解题的关键,注意基础知识的积累.

练习册系列答案
相关题目
 将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )
将一定量的CO2气体通入2L的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与消耗的HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).下列说法不正确的是( )| A、O点溶液中所含溶质的化学式为NaOH、Na2CO3 |
| B、O到a点发生反应的离子方程式:H++OH-=H2O、CO32-+H+=HCO3- |
| C、通入CO2气体的体积在标准状况下为44.8L |
| D、NaOH溶液的物质的量浓度为5mol?L-1 |
科学家相信,第七周期包含的元素数目与第六周期相同,若118号元素将来被确认,则下列预测合理的是( )
| A、它的中子数是118 |
| B、它是第八周期元素 |
| C、它是活泼的金属元素 |
| D、它的最外层电子数是8 |
在25℃时,密闭容器中X、Y、Z三种气体的浓度如下表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度/mol?L-1 | 0.1 | 0.2 | 0 |
| 平衡浓度/mol?L-1 | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、改变温度可以改变此反应的平衡常数 |
| C、反应可表示为X+3Y?2Z,平衡常数为1600 |
| D、增大压强使平衡向生成Z的方向移动,平衡常数增大 |
下列物质能由单质直接化合而成的是( )
| A、FeCl2 |
| B、FeCl3 |
| C、CuS |
| D、SO3 |
现有三种常见治疗胃病药品的标签:

药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较(同剂量),正确的是( )

药品中所含的物质均能中和胃里过量的盐酸,下列关于三种药片中和胃酸的能力比较(同剂量),正确的是( )
| A、③>②>① |
| B、①>②>③ |
| C、②>③>① |
| D、①=②=③ |
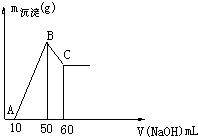 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol/L NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.


