题目内容
5.下列说法不正确的是( )| A. | 一般情况下,σ键比π键重叠程度大,形成的共价键更强 | |
| B. | 两个原子之间形成共价键时,最多有一个σ键 | |
| C. | 气体单质分子中,一定有σ键,可能有π键 | |
| D. | 杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对 |
分析 A.σ键头碰头重叠,π键肩并肩重叠,σ键重叠程度大;
B.两个原子之间形成共价键,如氮气中存在N≡N;
C.稀有气体的单质中不存在化学键;
D.杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子对;
解答 解:A.σ键头碰头重叠,π键肩并肩重叠,σ键重叠程度大,形成的共价键强,故A正确;
B.两个原子之间形成共价键,如氮气中存在N≡N,最多有一个σ键,故B正确;
C.稀有气体的单质中不存在化学键,则不含σ键、π键,故C错误;
D.杂化轨道只用于形成σ键或者用来容纳未参与成键的孤电子,故D正确;
故选C.
点评 本题考查共价键及类型,注意把握共价键形成的一般规律及类型的判断,注意特例,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
16.下列表示方法正确的是( )
①CH4分子的比例模型:
②四氯化碳分子的电子式为: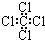
③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型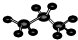
①CH4分子的比例模型:

②四氯化碳分子的电子式为:
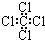
③乙烯的结构简式 CH2CH2
④丙烷分子的球棍模型

| A. | ①④ | B. | ①②④ | C. | ①②③④ | D. | ②③ |
13.下列物质中一定互为同系物的是( )
| A. | CH2=CH2和CH2=CH-CH=CH2 | B. | C4H8和C6H12 | ||
| C. | 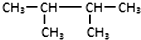 和(CH3)2CHCH(CH3)2 和(CH3)2CHCH(CH3)2 | D. | C2H6和C4H10 |
17.下面的排序不正确的是( )
| A. | 沸点由高到低:HF>HCl | B. | 熔点由高到低:K>Li | ||
| C. | 硬度由大到小:金刚石>晶体硅 | D. | 晶格能由大到小:NaF>NaCl |
15.下表是 25℃时某些弱酸的电离平衡常数.
下列有关说法不正确的是( )
| 化学式 | CH3COOH | HClO | H2CO3 | H2C2O4 |
Ka | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 | Ka1=5.9×10-2 Ka2=6.4×10-5 |
| A. | 若H2C2O4 与等物质的量的 KOH反应后所得溶液呈酸性,则该溶液中各离子浓度由大到小的顺序为:c(K+)>c( HC2O4-)>c( H+)>c( C2O42-)>c( OH-) | |
| B. | 碳酸钠溶液中滴加少量氯水的离子方程式为:CO32-+Cl2+H2O=Cl-+HClO+HCO3- | |
| C. | 常温下,0.1mol/LCH3COOH 溶液加水稀释过程中,表达式c( H+)/c( CH3COOH )的数据变大 | |
| D. | pH相同的 NaClO 和 CH3COOK 溶液,其溶液的物质的量浓度的大小关系是:c( CH3COOK )>c( NaClO ) |
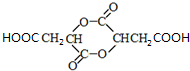 .
.  .
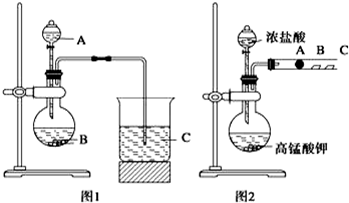
.

 .
.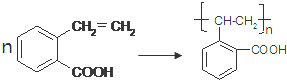 .
.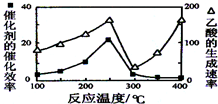 CH4和CO2可以制造价值更高的化学产品.已知:
CH4和CO2可以制造价值更高的化学产品.已知: