题目内容
3.常温下,在35.5g水中溶解12.5g CuSO4•5H2O,恰好达到饱和,该溶液密度为1.20g/cm3,求:(1)该溶液中阴阳离子的总物质的量;
(2)该溶液中CuSO4的物质的量浓度.
分析 (1)根据硫酸铜的质量计算物质的量,分别计算阴阳离子的物质的量,可得阴阳离子的总物质的量;
(2)根据溶液的质量和密度计算溶液的体积,物质的量除以体积可得物质的量浓度.
解答 解:(1)CuSO4的物质的量为:$\frac{12.5g}{250g/mol}$=0.05mol,电离产生的Cu2+和SO42-均为0.050mol,故阴阳离子的总物质的量为:0.05mol+0.05mol=0.1mol,
答:阴阳离子的总物质的量为0.1mol;
(2)溶液的体积为:$\frac{12.5g+35.5g}{1.2×1000g/L}$=0.04L,故CuSO4的物质的量浓度为:$\frac{0.05mol}{0.04L}$=1.25mol/L,
答:CuSO4的物质的量浓度为1.25mol/L.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量之间的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
13.用下列装置进行相应实验,装置正确且能达到实验目的是( )
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 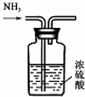 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 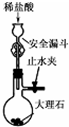 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
18.下列各组反应,前后均可以用同一个离子方程式表示的是( )
| A. | HCl+Na2CO3 HCl+NaHCO3 | B. | HCl+Na2CO3 H2SO4+K2CO3 | ||
| C. | H2S+NaOH H2SO4+KOH | D. | BaCl2+Na2SO4 BaCO3+H2SO4 |
8.下列有关胶体的叙述正确的是( )
| A. | 直径介于1--10nm之间的粒子称为胶体 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 氢氧化铁胶体是纯净物 | |
| D. | 可以通过过滤的方法分离胶体和溶液 |
12.联苯是一种芳香烃,结构为两个苯环被一条单键连接,其一氯代物和二氯代物种类数分别是( )
| A. | 3、12 | B. | 3、10 | C. | 5、12 | D. | 5、10 |
13.实验室需要100mL浓度分别是1mol•L-1、0.5mol•L-1、0.5mol•L-1的KCl、MgCl2、Na2S04的混合液现缺少KCl而用K2S04代替,其中能达到配置目的是( )
| A. | 将0.1mol K2S04、0.1mol NaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| B. | 将0.05mol K2S04、0.1mol NaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| C. | 将0.1mol K2S04、0.05mol NaCl、0.05molMgCl2溶于水制成100mL溶液 | |
| D. | 将0.05mol K2S04、0.1mol NaCl、0.05molMgCl2、100mL水制成溶液 |
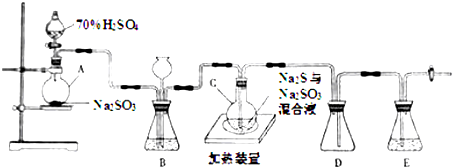
 .
.