��Ŀ����
�����Ѿ�����Ӱ�����ǵ����滷�����������糧�ͷų������ĵ������NOx������������Ͷ�����̼���������ɻ�����Ⱦ��

��1�����ü������ԭNOx��
CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H1=-574kJ?mol-1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ?mol-1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ ��
��2����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H3
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH�� �뷴Ӧ�¶�T�Ĺ�ϵ���ߣ���ͼ�ף���������CO2ת��Ϊ�״���Ӧ�ġ�H3 0�����������������=������
����һ���º����ܱ������г���1mol CO2��3mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ����ʾ������˵����ȷ���� ������ĸ���ţ���
A����10min������������ٳ���1mol CO2��3mol H2�����ٴδﵽƽ��ʱc��CH3OH��=1.5mol/L
B���ﵽƽ��ʱ��������ת����Ϊ0.75
C��0��10�����ڣ�������ƽ����Ӧ����Ϊ0.075mol/��L?min��
D�����¶��£���Ӧ��ƽ�ⳣ����ֵΪ
E�������¶Ƚ�ʹ
����
��3��ij���������н���������������һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ��������е�SO2��NO2�����ʵ���֮��Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4���绯ѧ����NO
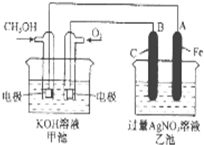
��ԭ������ͼ����ʾ��
�ٵ�Դ����Ϊ ���A����B������������ӦʽΪ ��
������������ת����1mol���ӣ���Ĥ������Һ�������仯���m��-��m����Ϊ g��

��1�����ü������ԭNOx��
CH4��g��+4NO2��g���T4NO��g��+CO2��g��+2H2O��g����H1=-574kJ?mol-1
CH4��g��+4NO��g���T2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ?mol-1
����ֱ�ӽ�NO2��ԭΪN2���Ȼ�ѧ����ʽΪ
��2����CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��CO2��g��+3H2��g���TCH3OH��g��+H2O��g����H3
��ȡ��ݵ����CO2��H2�Ļ�����壨���ʵ���֮�Ⱦ�Ϊ1��3�����ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�����������Ӧ����Ӧ��ͬʱ���ü״�����������գ�CH3OH�� �뷴Ӧ�¶�T�Ĺ�ϵ���ߣ���ͼ�ף���������CO2ת��Ϊ�״���Ӧ�ġ�H3
����һ���º����ܱ������г���1mol CO2��3mol H2������������Ӧ�����CO2��CH3OH��g����Ũ����ʱ��仯��ͼ����ʾ������˵����ȷ����
A����10min������������ٳ���1mol CO2��3mol H2�����ٴδﵽƽ��ʱc��CH3OH��=1.5mol/L
B���ﵽƽ��ʱ��������ת����Ϊ0.75
C��0��10�����ڣ�������ƽ����Ӧ����Ϊ0.075mol/��L?min��
D�����¶��£���Ӧ��ƽ�ⳣ����ֵΪ
| 3 |
| 16 |
E�������¶Ƚ�ʹ
| n(CH3OH) |
| n(CO2) |
��3��ij���������н���������������һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ��������е�SO2��NO2�����ʵ���֮��Ϊ1��1����÷�Ӧ�Ļ�ѧ����ʽΪ
��4���绯ѧ����NO
- 3 |
�ٵ�Դ����Ϊ
������������ת����1mol���ӣ���Ĥ������Һ�������仯���m��-��m����Ϊ
���㣺���ʵ�����Ũ����ʱ��ı仯����,�Ȼ�ѧ����ʽ,��ѧ��Դ���͵��,��ѧƽ���Ӱ������
ר�⣺�����������������
��������1�����ø�˹���ɷ�����
��2������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬����ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС������ƽ�����淴Ӧ���У��ݴ��жϣ�
��A���ٳ���1mol CO2��3mol H2���ɵ�ЧΪ��ʼ�����Ϊԭ����2��������2mol CO2��6mol H2��ƽ����ٽ����ѹ��Ϊԭ�������������ѹǿƽ���������С�ķ����ƶ�����������Ӧ�ƶ�����Ӧ���ת��������
B������v=
����v��H2���жϣ�
C������ת���ʵĶ�������жϣ�
D�����¶��¸÷�Ӧ��K=
���������ݼ��㣻
E���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�n��CH3OH����С��n��CO2������
��3�����ݷ�Ӧ������������غ�ķ�����д��ѧ����ʽ��
��4������ͼʾ֪��Ag-Pt�缫��NO3-������ԭ��Ӧ�����Ag-Pt�缫Ϊ��������BΪ������AΪ��Դ��������������Ӧ��NO3-�õ��ӷ�����ԭ��Ӧ����N2�����õ���غ���ԭ���غ�֪�������Ӳ��뷴Ӧ����ˮ���ɣ�
��ת��2mol����ʱ��������������ӦΪH2Oʧ��������ΪO2��H+������1molˮ������2molH+���������ң���������������18g���������зų�0.2molN2��5.6g����ͬʱ��2molH+��2g�����������ң�
��2������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬����ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС������ƽ�����淴Ӧ���У��ݴ��жϣ�
��A���ٳ���1mol CO2��3mol H2���ɵ�ЧΪ��ʼ�����Ϊԭ����2��������2mol CO2��6mol H2��ƽ����ٽ����ѹ��Ϊԭ�������������ѹǿƽ���������С�ķ����ƶ�����������Ӧ�ƶ�����Ӧ���ת��������
B������v=
| ��n |
| ��t |
C������ת���ʵĶ�������жϣ�
D�����¶��¸÷�Ӧ��K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
E���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�n��CH3OH����С��n��CO2������
��3�����ݷ�Ӧ������������غ�ķ�����д��ѧ����ʽ��
��4������ͼʾ֪��Ag-Pt�缫��NO3-������ԭ��Ӧ�����Ag-Pt�缫Ϊ��������BΪ������AΪ��Դ��������������Ӧ��NO3-�õ��ӷ�����ԭ��Ӧ����N2�����õ���غ���ԭ���غ�֪�������Ӳ��뷴Ӧ����ˮ���ɣ�
��ת��2mol����ʱ��������������ӦΪH2Oʧ��������ΪO2��H+������1molˮ������2molH+���������ң���������������18g���������зų�0.2molN2��5.6g����ͬʱ��2molH+��2g�����������ң�
���
�⣺��1����֪��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=-574kJ?mol-1
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ?mol-1
���ܻ�ѧ��Ӧ��һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ���ʽ��ӣ��ɵ�
2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=-1734 kJ/mol
��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ?mol-1
�ʴ�Ϊ��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ?mol-1��
��2������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��˵�������¶�ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H3��0���ʴ�Ϊ������
����ͼ2��֪����ʼ������̼��Ũ��Ϊ1.0mol/L����ʼ�����г���1mol CO2��3mol H2�����Կ�ʼ������Ũ��Ϊ3.0mol/L���������Ϊ
=1L��
ƽ��ʱ���״���Ũ��Ϊ0.75mol/L
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L����1 3 0 0
�仯��mol/L����0.75 2.25 0.75 0.75
ƽ�⣨mol/L����0.25 0.75 0.75 0.75
A��ͨ�����������֪������̼��ת����Ϊ
��100%=75%���ٳ���1mol CO2��3mol H2���ɵ�ЧΪ��ʼ�����Ϊԭ����2��������2mol CO2��6mol H2��ƽ����ٽ����ѹ��Ϊԭ�������������ѹǿƽ���������С�ķ����ƶ�����������Ӧ�ƶ�����Ӧ���ת�������������ٴδﵽƽ��ʱc��CH3OH����1.5mol/L����A����
B��ͨ�����������֪������ת����Ϊ
��100%=75%����B��ȷ��
C��10�����ڣ�������ƽ����Ӧ����Ϊv��H2��=
=0.225mol/��L?min������C����
D�����¶��¸÷�Ӧ��K=
=
=
����D����
E���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�n��CH3OH����С��n��CO2����������
ֵ��С����E����
��ѡ��B��
��3�������е�SO2��NO2�����ʵ���֮��Ϊ1��1��һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ�����12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3��
�ʴ�Ϊ��12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3��
��4������ͼʾ֪��Ag-Pt�缫��NO3-������ԭ��Ӧ�����Ag-Pt�缫Ϊ��������BΪ������AΪ��Դ��������������Ӧ��NO3-�õ��ӷ�����ԭ��Ӧ����N2�����õ���غ���ԭ���غ�֪��H2O���뷴Ӧ����ˮ���ɣ�
���������Ϸ����ĵ缫��ӦʽΪ��2NO3-+12H++10e-=N2+6H2O��
�ʴ�Ϊ��A��2NO3-+12H++10e-=N2+6H2O��
��ת��2mol����ʱ��������������ӦΪH2Oʧ��������ΪO2��H+������1molˮ������2molH+���������ң���������������18g���������зų�0.2molN2��5.6g����ͬʱ��2molH+��2g�����������ң������������������3.6g����Ĥ������Һ�������仯���m��-��m�ң�=18g-3.6g=14.4g��ת��1mol���ӣ���Ĥ������Һ�������仯��7.2g��
�ʴ�Ϊ��7.2��
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2=-1160kJ?mol-1
���ܻ�ѧ��Ӧ��һ����ɻ��Ƿּ�����ɣ��䷴Ӧ������ͬ�ģ���ʽ��ӣ��ɵ�
2CH4��g��+4NO2��g��=2N2��g��+2CO2��g��+4H2O��g����H=-1734 kJ/mol
��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ?mol-1
�ʴ�Ϊ��CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=-867 kJ?mol-1��
��2������ͼ��֪��ߵ㷴Ӧ����ƽ�⣬��ƽ����¶�Խ�ߣ��գ�CH3OH��ԽС��˵�������¶�ƽ�����淴Ӧ���У������¶�ƽ�����ȷ�����У��淴ӦΪ���ȷ�Ӧ��������ӦΪ���ȷ�Ӧ������H3��0���ʴ�Ϊ������
����ͼ2��֪����ʼ������̼��Ũ��Ϊ1.0mol/L����ʼ�����г���1mol CO2��3mol H2�����Կ�ʼ������Ũ��Ϊ3.0mol/L���������Ϊ
| 1.0mol |
| 1.0mol/L |
ƽ��ʱ���״���Ũ��Ϊ0.75mol/L
CO2��g��+3H2��g��?CH3OH��g��+H2O��g��
��ʼ��mol/L����1 3 0 0
�仯��mol/L����0.75 2.25 0.75 0.75
ƽ�⣨mol/L����0.25 0.75 0.75 0.75
A��ͨ�����������֪������̼��ת����Ϊ
| 0.75mol/L |
| 1.0mol/L |
B��ͨ�����������֪������ת����Ϊ
| 2.25mol/L |
| 3mol/L |
C��10�����ڣ�������ƽ����Ӧ����Ϊv��H2��=
| 2.25mol/L |
| 10min |
D�����¶��¸÷�Ӧ��K=
| c(CH3OH)c(H2O) |
| c(CO2)c3(H2) |
| 0.75��0.75 |
| 0.25��0.753 |
| 16 |
| 3 |
E���÷�ӦΪ���ȷ�Ӧ�������¶�ƽ�����淴Ӧ���У�n��CH3OH����С��n��CO2����������
| n(CH3OH) |
| n(CO2) |
��ѡ��B��
��3�������е�SO2��NO2�����ʵ���֮��Ϊ1��1��һ�����İ�����������Ӧ����������狀�����淋Ļ������Ϊ����Ʒ���ʣ�����12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3��
�ʴ�Ϊ��12NH3+3O2+4SO2+4NO2+6H2O=4��NH4��2SO4+4NH4NO3��
��4������ͼʾ֪��Ag-Pt�缫��NO3-������ԭ��Ӧ�����Ag-Pt�缫Ϊ��������BΪ������AΪ��Դ��������������Ӧ��NO3-�õ��ӷ�����ԭ��Ӧ����N2�����õ���غ���ԭ���غ�֪��H2O���뷴Ӧ����ˮ���ɣ�
���������Ϸ����ĵ缫��ӦʽΪ��2NO3-+12H++10e-=N2+6H2O��
�ʴ�Ϊ��A��2NO3-+12H++10e-=N2+6H2O��
��ת��2mol����ʱ��������������ӦΪH2Oʧ��������ΪO2��H+������1molˮ������2molH+���������ң���������������18g���������зų�0.2molN2��5.6g����ͬʱ��2molH+��2g�����������ң������������������3.6g����Ĥ������Һ�������仯���m��-��m�ң�=18g-3.6g=14.4g��ת��1mol���ӣ���Ĥ������Һ�������仯��7.2g��
�ʴ�Ϊ��7.2��
������������ȼú����������̼������ȴ���Ϊ���壬���黯ѧƽ���й�ͼ��Ӧ���ʼ��㡢ƽ�ⳣ�����㡢Ӱ�컯ѧƽ������ء���Һ���Ƶȣ��Ѷ��еȣ�������ѧ�����������������������ע�⣨1������ͼ����ߵ��������ϵĸ��㶼��ƽ��״̬��

��ϰ��ϵ�д�
�����Ŀ
2013�����绷�����й�����Ϊ��ͬ���������ܶ��������ϸ��ع㷺��չ��һϵ�л�����л��������һ������ǣ�������
| A���ƽ��Է���PM2.5Ϊ�ص�Ĵ�����Ⱦ���ι��� |
| B�������ƹ���ܡ�̫���ܡ����ܵ�������Դ��ʹ�� |
| C����������������Ʒ���࣬ʵ����Դ��ѭ�� |
| D�������ܺġ�����Ⱦ����ҵǨ��ƫƧ��ũ���������ߵ��ؾ������� |
���и��������У���Ϊͬ���칹����ǣ�������
| A������ˮ |
| B�������ͳ��� |
| C��1H��3H |
| D�������Ǻ��� |
 ��ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��
��ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��


 ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
 ��֪�ס��ҡ�������4�����ʾ����г�������Ԫ��A�����м�Ϊ����ɫ��ĩ������֮������ͼ��ʾ��ת����ϵ��ת�������в��ֲ���δ�����
��֪�ס��ҡ�������4�����ʾ����г�������Ԫ��A�����м�Ϊ����ɫ��ĩ������֮������ͼ��ʾ��ת����ϵ��ת�������в��ֲ���δ�����