题目内容
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 在使石蕊试液变红的溶液中:Na+、K+、Br-、SO42- | |
| B. | 氯化亚铁溶液中:K+、Al3+、SO42-、MnO4- | |
| C. | 硫酸铝溶液中:K+、AlO2-、Na+、Cl- | |
| D. | 与铝反应产生大量氢气的溶液:NH4+、Na+、SO42-、NO3- |
分析 A.使石蕊试液变红的溶液呈酸性;
B.与Fe2+反应的离子不能大量共存;
C.与Al3+反应的离子不能大量共存;
D.与铝反应产生大量氢气的溶液可能呈酸性或碱性.
解答 解:A.使石蕊试液变红的溶液呈酸性,酸性条件下离子之间不发生任何反应,可大量共存,故A正确;
B.MnO4-与Fe2+发生氧化还原反应而不能大量共存,故B错误;
C.AlO2-与Al3+发生互促水解反应而不能大量共存,故C错误;
D.与铝反应产生大量氢气的溶液可能呈酸性或碱性,碱性条件下NH4+不能大量共存,酸性条件下NO3-不能大量共存,故D错误.
故选A.
点评 本题考查离子的共存,为高考常见题型,侧重信息的抽取和离子反应的考查,注意氧化还原反应为解答的难点,题目难度不大,题目有利于培养学生的分析能力和审题能力.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
14.反应A(g)+3B(g)?2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是( )
| A. | v(A)=0.35mol•L-1•min-1 | B. | v(B)=0.01mol•L-1•s-1 | ||
| C. | v(C)=0.40mol•L-1•min-1 | D. | v(D)=0.45mol•L-1•min-1 |
11.下列各物质相互混合进行反应,既有气体生成,最终又有白色沉淀生成的是( )
| A. | 金属钠投入CuSO4溶液中 | B. | 过量的NaOH溶液和明矾溶液反应 | ||
| C. | 金属钠投入MgSO4溶液中 | D. | 金属铝投入NaOH溶液中 |
18.在溶液中可以大量共存,加过量稀硫酸后有沉淀产生,同时有气体放出的离子组是( )
| A. | HCO3-、Na+、Cl-、Ba2+ | B. | AlO2-、S2-、Na+、K+ | ||
| C. | SiO32-、CO32-、K+、Na+ | D. | Ba2+、Al3+、NO3-、Cl- |
15.下列说法正确的是( )
| A. | 常温下,铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| B. | 包装食品里常有硅胶、石灰、还原铁粉三类小包,其作用相同 | |
| C. | 浓硫酸可用于干燥H2S和CO2 | |
| D. | 合金的物理性质一般与其各组分金属的物理性质相同 |
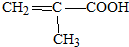 .
.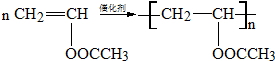 .
.
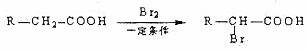 D可以发生如下转化关
D可以发生如下转化关 系:
系: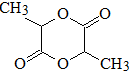 .并写出N发生消去反应的化学方程式CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
.并写出N发生消去反应的化学方程式CH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.