题目内容
将一铁片投入100ml一定浓度的 CuSO4溶液中,直至反应不再发生为止,称得铁片质量增重0.8克,则该CuSO4溶液物质的量浓度为 .
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:铁片增加的质量为析出铜的质量与溶解铁的质量差,根据铁片增重质量计算参加反应的硫酸铜的物质的量,最后根据C=
计算反应后溶液中CuSO4的物质的量浓度.
| n |
| V |
解答:
解:Fe和硫酸铜反应方程式为:Fe+CuSO4=FeSO4+Cu,铁片增加的质量为析出铜的质量与溶解铁的质量差,
设参加反应的CuSO4的物质的量是x,
Fe+CuSO4=FeSO4+Cu 固体增加质量
1mol (64-56)g
x 0.8
1mol:(64-56)g=x:0.8g
x=
=0.1mol,
则反应后溶液中硫酸铜的物质的量浓度=
=1mol/L,答:该CuSO4溶液物质的量浓度为1mol/L.
设参加反应的CuSO4的物质的量是x,
Fe+CuSO4=FeSO4+Cu 固体增加质量
1mol (64-56)g
x 0.8
1mol:(64-56)g=x:0.8g
x=
| 1mol×0.8g |
| (64-56)g |
则反应后溶液中硫酸铜的物质的量浓度=
| 0.1mol |
| 0.1L |
点评:本题考查了根据方程式进行计算,明确铁片增加的质量为“析出铜和溶解铁的质量差”是解本题关键,再结合差量法进行计算,题目难度不大.

练习册系列答案
相关题目
在下列实验操作中错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计的水银球放置于蒸馏烧瓶的支管出口稍下处 |
| C、用容量瓶配制溶液时,加水超过了刻度线,没有采取补救措施,重新配制 |
| D、将5.85gNaCl溶于100mL水中,即配成1.0 mol/L NaCl溶液 |
化合物丙可由如图反应得到:丙的结构不可能是( )
C4H10O(甲)
C4H8
(乙) C4H8Br2(丙)
C4H10O(甲)
| 浓H2SO4 |
| △ |
| Br2 |
| CCl4 |
| A、CH3CBr2CH2CH3 |
| B、(CH3)2CBrCH2Br |
| C、C2H5CHBrCH2Br |
| D、CH3(CHBr)2CH3 |
下列反应属于氧化还原反应但不属于置换反应的是( )
| A、NaOH+HCl=NaCl+H2O | ||||
B、C+H2O
| ||||
| C、2Na+2H2O=2NaOH+H2↑ | ||||
| D、2Na2O2+2H2O═4NaOH+O2↑ |
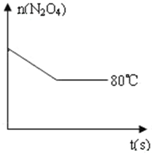 在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据:
在80℃时,0.40mol的N2O4气体充入2L固定容积的密闭容器中发生如下反应:N2O4(g)?2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析得到如下数据: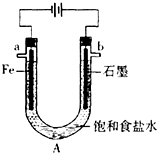 电解饱和食盐水装置的结构如图所示:
电解饱和食盐水装置的结构如图所示: