题目内容
3.下列实验设计所得结论不可靠的是( )| A. | 将电石与水反应产生的气体先通入CuSO4溶液再通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,说明该钾盐是K2CO3或K2SO3 | |
| C. | 将浓硫酸和乙醇溶液共热产生的气体干燥后通入溴的四氯化碳溶液,溶液褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,不能说明有HBr生成 |
分析 A.硫酸铜溶液除去了乙烯中的硫化氢,若酸性高锰酸钾溶液褪色,证明生成的乙炔;
B.生成的气体可能为二氧化碳或二氧化硫,该钾盐可能为碳酸氢钾或亚硫酸氢钾;
C.溴的四氯化碳溶液褪色,可以证明有乙烯生成;
D.液溴易挥发,挥发出来的溴能够与硝酸银溶液反应生成溴化银沉淀.
解答 解:A.将电石与水反应产生的气体中含有硫化氢,先通入CuSO4溶液除去杂质硫化氢,排除了干扰,再通入酸性KMnO4溶液中,溶液褪色能够说明有乙炔生成,故A正确;
B.某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色气体,该气体可能为二氧化碳或二氧化硫,该钾盐可能为KCO3或KHSO3,不一定为K2CO3或K2SO3,故B错误;
C.将浓硫酸和乙醇溶液共热产生的气体干燥后通入溴的四氯化碳溶液,溶液褪色,能够证明反应中有乙烯生成,故C正确;
D.液溴易挥发,产生的气体中含有溴单质,溴单质能够与到AgNO3溶液反应生成淡黄色沉淀,则不能说明有HBr生成,故D正确;
故选B
点评 本题考查了化学实验方案的评价,题目难度不大,涉及物质检验与鉴别、常见有机物结构与性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.下列说法中,正确的是( )
| A. | SO2能使FeCl3、酸性KMnO4溶液迅速褪色 | |
| B. | 可以用澄清石灰水来鉴别SO2与CO2 | |
| C. | 氨气和酸相遇都能产生白色烟雾 | |
| D. | 在反应NH3++H+=NH4+中,氨失去电子被氧化 |
18.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 已知H2O(l)=H2O(g)△H=+44 kJ/mol,则2gH2(g)完全燃烧生成液态水比生成气态水多释放22kJ的热量 | |
| C. | 硝酸铵溶于水温度降低,这个过程发生的是吸热反应 | |
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下△H的相同 |
8.常温下,已知Ksp(AgCl)>Ksp( AgBr),现将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,下列有关说法不正确的是( )
| A. | 根据Ksp(AgCl)>Ksp( AgBr),可知AgCl的溶解能力比AgBr强 | |
| B. | 加入足量浓AgNO3溶液后,AgCl和AgBr的溶度积Ksp均不变 | |
| C. | 加入足量浓AgNO3溶液后,溶液中只有AgBr沉淀 | |
| D. | 在含有AgBr、AgCl固体的悬浊液中,c (Cl-)>c (Br-) |
15.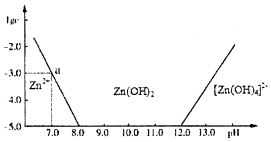 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
根据上表数据判断下列说法正确的是C D.
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
 锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.
锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性.(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:
①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为Zn2++4OH-═[Zn(OH)4]2-
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)=10-17.
③往1L 1.00mol•L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH1.80mol.
④己知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如表:
| C(HCl)/(mol•L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
| C(PbCl2)/(mol•L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50mol•L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌 能溶于氨水,生成配合物离子[Zn(NH3)4]2+.
①在25℃下,将a mol•L-1的NH4Cl溶液与0.01mol•L-1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=10-5(a-0.01)mol•L-1.
②若25℃时将浓度均为0.1mo1.L-1的NH4Cl、NH3•H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是bc(填字母).
a.此溶液一定有c(NH4+)+c(H+)=c(OH-)+c(Cl-)
b.此溶液一定有c(C1-)=c(NH3•H2O)+c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大.
13.某化学电源的工作原理如图.下列说法不正确的是( )
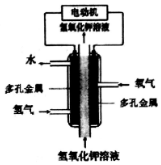

| A. | 采用多孔金属作电极可增大电极接触面积,提高对气体的吸附能力 | |
| B. | 通H2的电极作负极,发生氧化反应 | |
| C. | 通O2的电极发生的电极反应:O2+4e-+4H+=2H2O | |
| D. | 该电池工作时发生的主要能量转化形式为化学能转化为电能和热能 |
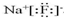 ,
, O2-
O2- .
.