题目内容
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可用如图1所示的发生装置制取X、Z和M(夹持装置已略).
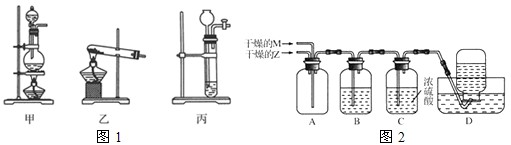
(1)X气体为 ,制取M的发生装置是(填写序号) .
(2)A中含有的化学键类型有 .
(3)已知Z能与M在常温下反应生成Y,同时有白烟产生.反应的化学方程式是 .
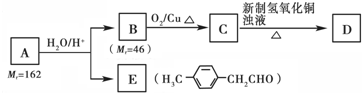
用图2所示装置进行Z与M在常温下反应的实验,并收集Y.
(4)若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足
.
(5)若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是 ; .

(1)X气体为
(2)A中含有的化学键类型有
(3)已知Z能与M在常温下反应生成Y,同时有白烟产生.反应的化学方程式是
用图2所示装置进行Z与M在常温下反应的实验,并收集Y.
(4)若从A中逸出的气体含有Z,则通入反应装置A中的Z和M的物质的量之比应满足
| n(Z) |
| n(M) |
(5)若从A中逸出的气体无论含有Z或M,经洗气瓶B后,均能被吸收,则洗气瓶B中试剂与Z、M反应的离子方程式分别是
考点:位置结构性质的相互关系应用,实验装置综合
专题:实验设计题,元素周期律与元素周期表专题
分析:通过题干选项推出位于三个不同周期三种单质反应,其中两种产物又可相互化合,则可以判断出X、Y、Z三种气体单质分别是H2、N2、Cl2,从而判断出M、A、N的名称;在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明所选试剂既能与Cl2反应,又能与NH3反应,因此可推测FeCl2溶液,形成氯气、氨气与氯化亚铁溶液反应的离子方程式.
解答:
解:相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期;在一定条件下,X与Y化合生成M、X与Z化合生成N、M能与N化合生成A,则X、Y、Z三种气体单质分别是H2、N2、Cl2,所以M为NH3、N为HCl、A为NH4Cl,
(1)根据分析可知,X为氢气,Z为氮气、M为氨气;装置甲为固+液加热制取气体装置,可以用甲装置制取Z氯气;装置乙为固+固加热制取气体装置,可以用于制取M氨气;丙为固+液不需要加热制取气体装置,可用于制取X氢气,故答案为:H2;乙;
(2)氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
故答案为:离子键、极性共价键;
(3)Z能与M在常温下反应生成Y,同时有白烟产生,Z为氯气、M为氨气,二者反应生成氯化铵和氮气,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(4)Z为NH3、M为Cl2,二者反应的方程式为:3Cl2+8NH3=6NH4Cl+N2,从A中逸出的气体含有Z,即氯气过量,则通入反应装置A中的Z和M的物质的量之比应满足:n(Cl2):n(NH3)>
,
故答案为:>
;
(5)在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明B所选试剂既能与Cl2反应,又能与NH3反应,因此可推测B可能为FeCl2溶液,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+、Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+.
(1)根据分析可知,X为氢气,Z为氮气、M为氨气;装置甲为固+液加热制取气体装置,可以用甲装置制取Z氯气;装置乙为固+固加热制取气体装置,可以用于制取M氨气;丙为固+液不需要加热制取气体装置,可用于制取X氢气,故答案为:H2;乙;
(2)氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
故答案为:离子键、极性共价键;
(3)Z能与M在常温下反应生成Y,同时有白烟产生,Z为氯气、M为氨气,二者反应生成氯化铵和氮气,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,
故答案为:3Cl2+8NH3=6NH4Cl+N2;
(4)Z为NH3、M为Cl2,二者反应的方程式为:3Cl2+8NH3=6NH4Cl+N2,从A中逸出的气体含有Z,即氯气过量,则通入反应装置A中的Z和M的物质的量之比应满足:n(Cl2):n(NH3)>
| 3 |
| 8 |
故答案为:>
| 3 |
| 8 |
(5)在B洗气瓶中既能吸收Cl2又能吸收NH3的试剂且让写出离子方程式,则说明B所选试剂既能与Cl2反应,又能与NH3反应,因此可推测B可能为FeCl2溶液,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+、Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+.
点评:本题主要考查了性质实验方案的设计,题目难度中等,解答关键在于通过题干信息推出位于三个不同周期三种单质的组成,注意掌握物质性质实验方案的设计原则.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
把0.05mol NaOH晶体分别加入到下列100mL液体中,溶液导电性变化较大的是( )
| A、0.5 mol?L-1 醋酸 |
| B、0.5 mol?L-1盐酸 |
| C、0.5 mol?L-1硫酸 |
| D、0.5 mol?L-1硝酸 |
下列离子方程式书写正确的是( )
| A、Ba(OH)2溶液与过量的NaHCO3溶液混合:Ba2++OH-+HCO3-=BaCO3↓+H2O |
| B、次氯酸钙溶液中通入少量SO2气体:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| C、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
下列物质中一定含有氢元素,不一定含有氧元素的是( )
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
①酸 ②酸式盐 ③碱 ④碱式盐 ⑤碱性氧化物.
| A、①② | B、①②③④ |
| C、②④ | D、①②④ |
对于可逆反应:2A(g)+B(g)?xC(g)△H,达平衡后,下列说法正确的是( )(注:a表示转化率)
| A、其他条件不变情况下,增加A(g)的质量,则a(A)降低,a(B)升高 |
| B、其他条件不变情况下,增加压强,a(A)升高,则x>3 |
| C、其他条件不变情况下,升高温度,a(A)降低,则△H>0 |
| D、其他条件不变情况下,加入催化剂,则平衡右移 |
金属晶体的堆积方式、空间利用率和配位数关系正确的是( )
| A、钋Po--简单立方堆积--52%--6 |
| B、钠Na--钾型--74%--12 |
| C、锌Zn--镁型--68%--8 |
| D、银Ag--铜型--74%--8 |
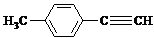 )的一条路线如下:
)的一条路线如下: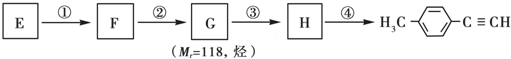
 实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液.