题目内容
恒温下,将a mol N2与b mol H2的混合气体通入一个容积为2L的密闭容器中,发生如下反应:N2(g)+3H2(g)?2NH3(g)若反应进行到5min时,测得n (N2)=13mol,n (NH3)=6mol,计算a值及N2的起始浓度(要有计算过程)
考点:化学平衡的计算
专题:
分析:根据化学平衡的三段式计算出a值及N2的起始浓度.
解答:
解:N2(g)+3H2(g)?2NH3(g)
起始(mol) a b 0
变化(mol) 3 9 6
5min(mol) 13 b-9 6
可得a-3=13,a=16,
N2的起始浓度c=
=8mol/L.
答:a的值为16,N2的起始浓度为8mol/L.
起始(mol) a b 0
变化(mol) 3 9 6
5min(mol) 13 b-9 6
可得a-3=13,a=16,
N2的起始浓度c=
| 16mol |
| 2L |
答:a的值为16,N2的起始浓度为8mol/L.
点评:本题考查化学平衡的计算,题目难度不大,注意利用三段式法结合化学方程式计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述正确的是( )
| A、摩尔是指物质所含的粒子个数,它是物质的数量单位 |
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 |
| C、0.012kgC原子中的原子数为1mol |
| D、在标准状况下,CH4与CO2混合物22.4L,所含有的分子数为NA |
下列实验操作不正确的是( )
A、 定容 |
B、 比较硫、碳、硅三种元素的非金属性强弱元素的非金属性强弱 |
C、 处理尾气 |
D、 测定黄铜(Cu、Zn合金)中Zn的含量 |
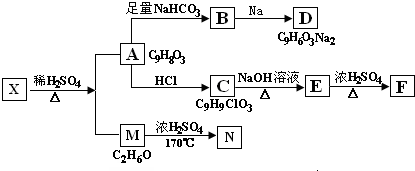
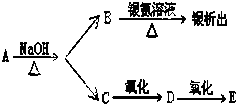 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.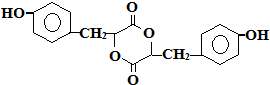 .
.