题目内容
6.下列有关物质的性质与用途具有对应关系的是( )| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 氧化镁熔点高,可用于耐高温材料 |
分析 A.氢氧化铝具有吸附性,不具有氧化性,不能杀菌消毒;
B.依据铝热反应用途解答;
C.碳酸钠碱性太强;
D.耐高温材料应具有高的熔沸点.
解答 解:A.明矾溶于水能形成氢氧化铝胶体,具有吸附性,能够吸收水中固体杂质颗粒,可以净水,不具有氧化性,不用于自来水的杀菌消毒,故A错误;
B.铝能置换出氧化铁中的铁,可以用于焊接钢轨,但是考虑到经济性问题,所以不用于钢铁工业中大量冶炼铁,故B错误;
C.碳酸钠碱性太强,不能 用于治疗胃酸过多,可用于碳酸氢钠治疗,故C错误;
D.氧化镁熔点高,可用于耐高温材料,故D正确;
故选:D.
点评 本题考查了元素化合物知识,熟悉明矾净水原理、铝热反应应用是解题关键,题目难度不大.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
17.下列说法正确的是( )
| A. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
14.下列元素中,金属活泼性最强的是( )
| A. | Na | B. | Mg | C. | Al | D. | Li |
1.公共场所常使用一种电离式烟雾报警器,其主体是一个放有镅-241(${\;}_{95}^{241}$Am)放射源的电离室.${\;}_{95}^{241}$Am含有的中子数是( )
| A. | 51 | B. | 95 | C. | 146 | D. | 241 |
16.如表是元素周期表的一部分,回答下列问题
(1)表中元素②最简单氢化物的电子式为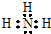 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ||||
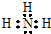 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.(2)工业生产单质④的原理是2Al2O3$\frac{\underline{\;\;\;通电\;\;\;}}{冰晶石}$4Al+3O2↑(用化学方程式表示).
(3)已知某些不同族元素的性质也有一定的相似性,如元素①与元素④的氢氧化物有相似的性质.写出元素①的氢氧化物与NaOH溶液反应的化学方程式:Be(OH)2+2NaOH=Na2BeO2+2H2O.
(4)0.2mol的单质⑥与100ml2mol•L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是1:1.
 NO2分子
NO2分子 X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.
X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数表化如下图所示.已知X的一种核素的质量数为18,中子数为10,Y和Ne原子的核外电子总数相差1;W的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强. .
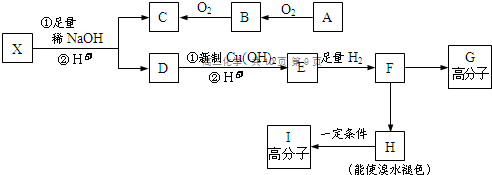
.
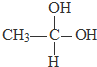 →CH3-CHO+H2O
→CH3-CHO+H2O ;
;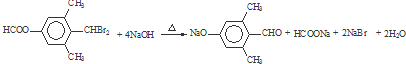 ;
;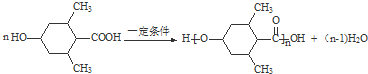 ;
;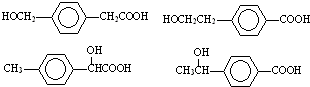 任意一种.
任意一种.


