题目内容
17.为了提纯表所列物质(括号内为杂质),请把除杂试剂和分离方法填入相应的表格中.| 题号 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| 1 | 丙烷(丙烯) | ||
| 2 | CH3CH2OH (CH3COOH) | ||
| 3 | 苯(溴) | ||
| 4 | 乙烯(SO2、CO2) | ||
| 5 | CO2(SO2) |
分析 1.丙烯与溴水反应,丙烷不能;
2.CaO与乙酸反应后,增大与乙醇的沸点差异;
3.溴与NaOH反应后,与苯分层;
4.SO2、CO2均与NaOH反应,而乙烯不能;
5.SO2与碳酸氢钠反应生成CO2,以此来解答.
解答 解:1.丙烯与溴水反应,丙烷不能,选洗气法分离;
2.CaO与乙酸反应后,增大与乙醇的沸点差异,然后选择蒸馏法分离;
3.溴与NaOH反应后,与苯分层,然后选分液法分离;
4.SO2、CO2均与NaOH反应,而乙烯不能,选洗气法分离;
5.SO2与碳酸氢钠反应生成CO2,选洗气法分离,
故答案为:
| 序号 | 除杂试剂 | 分离方法 |
| 1 | 溴水 | 洗气 |
| 2 | CaO(生石灰) | 蒸馏 |
| 3 | NaOH溶液 | 分液 |
| 4 | NaOH溶液 | 洗气 |
| 5 | 饱和NaHCO3溶液 | 洗气 |
点评 本题考查混合物分离提纯,为高考常见题型,侧重于学生的分析与实验能力的考查,把握物质的性质、性质差异、分离方法选择为解答该类题目的关键,注意有机物性质的应用,题目难度不大.

练习册系列答案
相关题目
5.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 mol氦气中有2NA个氦原子 | |
| B. | 14 g氮气中含6.02×1023个氮原子 | |
| C. | 2 L 0.3 mol•L-1 Na2SO4溶液中含0.6 NA个Na+ | |
| D. | 18 g水中所含的电子数为10NA |
12.化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
| A. | 土壤胶体带负电荷,有利于铵态氮肥的吸收 | |
| B. | 加工后具有吸水性的植物纤维可用作食品干燥剂 | |
| C. | 太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置 | |
| D. | 燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
9.下列说法不正确的是( )
| A. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| B. | 加热、蒸发MgCl2饱和溶液可得无水MgCl2晶体 | |
| C. | 工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 | |
| D. | 用浸泡过高锰酸钾溶液的硅土吸收水果释放的乙烯,可达到水果保鲜的目的 |
 2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害.
2014年1月4日,国家减灾办、民政部首次将危害健康的雾霾天气纳入2013年自然灾情进行通报.雾霾的形成与汽车尾气和燃煤有直接的关系,新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害. ②
② ③
③ ④
④ ⑤
⑤ ⑥
⑥
 ⑧
⑧ ⑨
⑨ ⑩
⑩




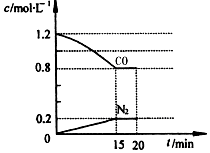
 工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题:
工业上常用水蒸气通过炽热的焦炭制得水煤气(主要成分为CO和H2),其反应的化学方程式为C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1.请回答下列问题: