题目内容
18.下列有关实验叙述正确的是( )| A. | 稀释浓硫酸时,要将水沿器壁慢慢倒入浓硫酸中,并不断搅拌 | |
| B. | 实验需要0.1 mol•L-1的Na2CO3溶液480 mL,配制时需用500 mL容量瓶 | |
| C. | 在测量温度时,温度计水银球紧贴容器内壁不影响测量结果 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
分析 A.稀释浓硫酸时要将浓硫酸慢慢倒入水中,并不断搅拌;
B.没有480mL的容量瓶;
C.温度计的水银球不能接触容器内壁,否则会影响测定结果;
D.萃取剂与水不能互溶,应分层,从碘水中提取单质碘时,可用CCl4,不可用无水乙醇代替.
解答 解:A.稀释浓硫酸时要将浓硫酸慢慢倒入水中,并不断搅拌,防止液体飞溅,故A错误;
B.没有480mL的容量瓶,可配制500mL溶液量取480mL,故B正确;
C.测量或监测温度时,温度计水银球不能碰到容器内壁,否则读数不准确,会影响测量结果,故C错误;
D.萃取剂与水不能互溶,应分层,碘易溶于水四氯化碳,且四氯化碳不溶于水,可用萃取分液法分离,而酒精与碘水中的水互溶,不分层,不可用无水乙醇代替CCl4,故D错误.
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
8.反应:①PCl5(g)═PCl3(g)+Cl2(g) ②2HI(g)═H2(g)+I2(g)③2NO2(g)═N2O4(g)在一定条件下,达到化学平衡时,反应物的转化率均是a%,若保持各反应的温度和容器的体积都不改变,分别再加入一定量的各自的反应物,则转化率( )
| A. | ①减小,②不变,③减小 | B. | ①增大,②不变,③减小 | ||
| C. | ①增大,②不变,③增大 | D. | ①减小,②不变,③增大 |
9.已知25℃时部分弱电解质的电离平衡常数数据如表所示:
下列物质的量浓度均为0.1mol•L-1的四种溶液中pH最大的是( )
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | CH3COONa | B. | Na2CO3 | C. | NaClO | D. | NaHCO3 |
6.下列有关苯酚的实验事实中,能说明侧链对苯环性质有影响的是( )
| A. | 1mol苯酚与3mol H2发生加成反应 | B. | 苯酚能和NaOH溶液反应 | ||
| C. | 苯酚燃烧产生带浓烟的火焰 | D. | 苯酚与浓溴水反应生成三溴苯酚 |
13.在恒温恒容条件下,能使反应:A(g)+B(g)?C(g)+D(g)正反应速率增大的是( )
| A. | 减小C或D的浓度 | B. | 减小B的浓度 | C. | 增大A或B的浓度 | D. | 减小A的浓度 |
3.下列实验叙述正确的是( )
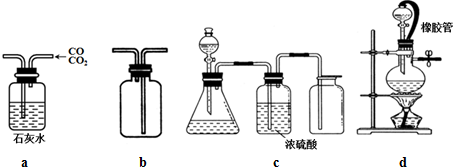

| A. | 用a装置除去混合气体中的杂质CO2 | |
| B. | 用b装置排气法收集H2、NH3、Cl2 | |
| C. | c装置用于碳酸钙和浓盐酸反应制取纯净CO2 | |
| D. | d中橡胶管可使烧瓶内的压强与大气压保持一致,便于液体滴下 |
10.下列物质的用途(括号内为用途)错误的是( )
| A. | 二氧化硅(光导纤维) | B. | 晶体硅(计算机芯片) | ||
| C. | 氧化铝(耐火材料) | D. | 氧化钠(供氧剂) |
8.反应:2H2(g)+O2(g)═2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
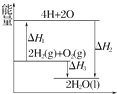

| A. | △H<0 | B. | △H2为该反应的反应热 | ||
| C. | △H3不是H2的燃烧热 | D. | △H3=△H1+△H3 |
