题目内容
(10分)(1)实验室要配制100 mL 2 mol/L NaCl溶液,请回答下列问题:
(1)配制过程中需要使用的主要玻璃仪器包括烧杯、玻璃棒、胶头滴管、量筒和___________。
(2)用托盘天平称取氯化钠固体,其质量为__________ g。
(3)列主要操作步骤的正确顺序是___________(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解;
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(4)如果实验过程中缺少步骤⑤,会造成所配溶液的物质的量浓度_______(填“偏高”或“偏低”或“无影响”,下同);若定容时俯视容量瓶刻度 线,会造成所配溶液的物质的量浓度_________。
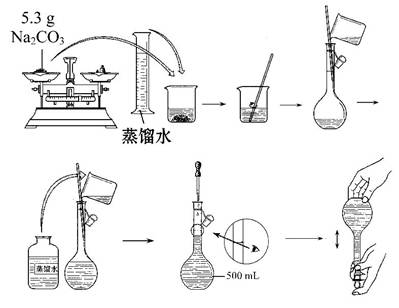
(2)实验室可用如图装置制备少量蒸馏水:
①温度计水银球处于 处,全程严格控制好温度
②液体量不超过烧瓶体积的1/3,投放少量碎瓷片,防止_________。
③先通冷凝水,再加热;冷凝管中的水流方向应为 ;
④刚开始收集到的馏分应弃去;结束时先 ,再 。
(1)100 mL容量瓶 (2)11.7 (3)①③⑤②④ (4)偏低 偏高(2)支管口 暴沸 下进上出 停止加热 关闭冷凝水
解析试题分析:(1)配制一定物质的量浓度的溶液一定要用到容量瓶,(2)NaCl的物质的量为n="cV=2" mol/L×0.1L=0.2mol,质量为m="nM=0.2" mol×58.5g/mol=11.7g(3)配制一定物质的量浓度溶液时主要操作有:称量、溶解、移液,洗涤、定容、摇匀等,故操作顺序是①③⑤②④。(4)如果实验过程中缺少步骤⑤,会造成溶质与损失,那么浓度会偏小,若定容时俯视容量瓶刻度线会造成溶液的体积偏小,浓度就偏大。(2)这是个蒸馏装置图①温度计水银球处于支管口处。②碎瓷片作用是防止液体暴沸。③冷凝管中的水流方向应为下进上出。④蒸馏结束时停止加热再关闭冷凝水,让最后的气体成分冷却。
考点:一定物质的量浓度溶液的配制和蒸馏操作。

下列所述情况中,可能引起水污染的是:
①城市生活污水的任意排放 ②农业生产中农药、化肥使用不当
③海上油轮石油泄漏 ④工业生产中废液、废渣、废气的排放
| A.只有①③ | B.只有①④ | C.只有②④ | D.①②③④ |
(10分)某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
(1)该同学应选择________mL的容量瓶。
(2)其操作步骤如下图所示,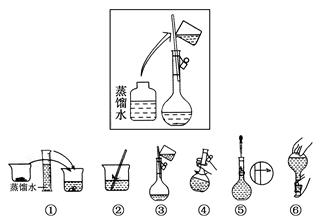
则如图操作应在下图中的________(填选项字母)之间。
A.②与③ B.①与② C.④与⑤
(3)该同学应称取NaOH固体________g,用质量为23.1 g的烧杯放在托盘天平上称取所需NaOH固体时,请在附表中选取所需的砝码大小________(填字母),并在下图中选出能正确表示游码位置的选项________(填字母)。
附表 砝码规格
| | a | b | c | d | e |
| 砝码大小/g | 100 | 50 | 20 | 10 | 5 |
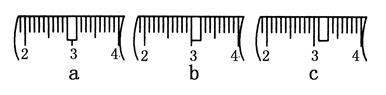
(4)下列操作对所配溶液的浓度大小有何影响?
①转移完溶液后未洗涤玻璃棒和烧杯,浓度会________(填“偏大”、“偏小”或“无影响”,下同)
②容量瓶中原来有少量蒸馏水,浓度会________。
(17分)科学探究
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究。请按要求填写。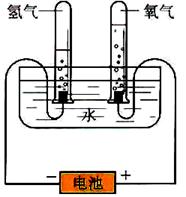
(1)观察不同时间试管内的H2和O2体积的比值均约为 。
(2)假设电解了1.8g H2O,根据电解水的化学方程式计算生成H2、O2的质量,计算过程如下:
并填表如下:
| | 质量g | 物质的量mol | H2和O2物质的量的比 |
| H2 | | | |
| O2 | | |
(3)下表列出了一些物质的体积
| 条件 | 物质 | 1 mol物质的体积 |
| 0℃101kPa | H2 | 22.3 L |
| O2 | 22.4 L | |
| CO2 | 22.4 L | |
| 25℃101kPa | H2 | 24.4L |
| O2 | 24.5L | |
| CO2 | 24.5L |
根据上表数据,得出的结论是(至少写出三点)
①在相同的温度压强下,
②
③
④
(4)请从微观的角度解释气体体积变化规律的原因:
下列物质能与水反应放出氧气的是
| A.氧化钠 | B.过氧化钠 | C.碳酸钠 | D.硫酸钠 |