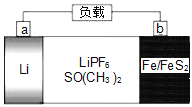
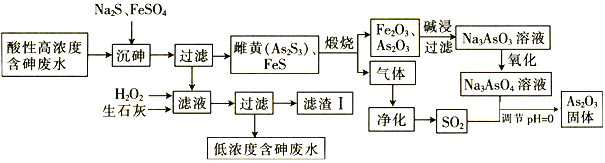
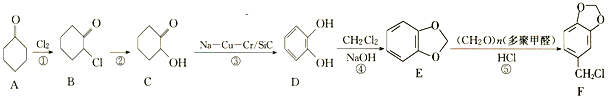
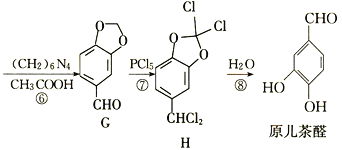
题目内容
【题目】(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),在光照和点燃条件下的△H(化学计量数相同)分别为△H1、△H2,△H1_____△H2(填“>”“<”或“=”,下同)。
(2)相同条件下,1 mol P4所具有的能量_______4 mol P原子所具有的能量。
(3)己知P4(白磷,s)![]() 4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
4P(红磷,s) △H=-17 kJ· mol-1,比较下列反应中△H的大小:△H1_____△H2。
①P4(白磷,s)+5O2(g)=P4O10(s) △H1,
②4P(红磷,s)+5O2(g)=P4O10(s) △H2。
(4)己知:稀溶液中,H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ· mol-1,则浓硫酸与稀氢氧化钠溶液反应生成2 mol水,放出的热量______114.6kJ。
(5)己知:28gFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了a kJ热量,该反应的热化学方程式是___________________________________。
【答案】= < < > Fe(s) + CO2(g) = FeO(s) + CO(g) △H = 2a kJ·mol-1
【解析】
(1)反应热与反应条件无关;
(2)化学键断裂为吸热过程,新键生成放热的过程;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多;
(4)浓硫酸溶于水放热;
(5)根据热化学方程式的含义以及书写方法来回答
(1).反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同,
故答案为:=;
(2).1molP4分子生成4molP分子要破坏化学键,需要吸热,则1molP4所具有的能量小于4molP分子所具有的能量,
故答案为:<;
(3).已知4P(白磷,s)P4(红磷,s)△H=-17 kJ· mol-1,说明白磷能量高,则燃烧反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,则△H1<△H2;
故答案为:<;
(4).浓硫酸溶于水放热,浓硫酸和稀氢氧化钠溶液反应生成2mol水,放出的热量大于114.6kJ,
故答案为:>;
(5).28g 即物质的量=![]() =0.5molFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了akJ热量,所以1molFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了2akJ热量,热化学方程式为:Fe(s) + CO2(g) = FeO(s) + CO(g) △H =+2a kJ·mol-1,
=0.5molFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了akJ热量,所以1molFe(s)与CO2(g)在一定条件下,完全反应生成FeO(s)和CO(g),吸收了2akJ热量,热化学方程式为:Fe(s) + CO2(g) = FeO(s) + CO(g) △H =+2a kJ·mol-1,
故答案为:Fe(s) + CO2(g) = FeO(s) + CO(g) △H =+2a kJ·mol-1。

【题目】如图所示,x、y分别是直流电源的两极,通电后发现a极极板处有无色、无味的气体放出,b极极板质量增加,符合这一情况的是( )
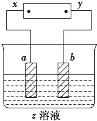
选项 | a极板 | b极板 | x电极 | z溶液 |
A | 锌 | 石墨 | 正极 | CuSO4 |
B | 石墨 | 石墨 | 负极 | NaOH |
C | 石墨 | 银 | 正极 | AgNO3 |
D | 铜 | 石墨 | 负极 | CuCl2 |
A.AB.BC.CD.D