题目内容
11.71g某物质Na2XO4中含钠离子的个数约为6.02×1023,写出该物质的化学式为Na2SO4.分析 根据钠离子的个数结合物质的构成可计算Na2XO4的物质的量,根据M=$\frac{m}{n}$计算Na2XO4的摩尔质量,可确定X的相对原子质量,确定元素的种类,可确定物质的化学式.
解答 解:n(Na+)=$\frac{6.02×10{\;}^{23}}{6.02×10{\;}^{23}/mol}$=1mol,则n(Na2XO4)=0.5mol,M(Na2XO4)=$\frac{71g}{0.5mol}$=142g/mol,可知X的相对原子质量为142-2×23-4×16=32,应为S元素,则该物质为Na2SO4,
故答案为:Na2SO4.
点评 本题考查物质的量的相关计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
相关题目
5.下列各化合物中,能发生酯化、加成、消去、氧化、还原五种反应的是( )
| A. | CH3-CH═CH-CHO | B. |  | ||
| C. | HOCH2-CH2-CH═CH-CHO | D. |  |
19.下列各组溶液,不用其它试剂即可鉴别的是( )
| A. | KCl NaHSO4 KHCO3 | B. | Na2SO4 BaCl2 Na2CO3 | ||
| C. | NaHCO3 Ba(OH)2 NaHSO4 | D. | Ca(OH)2 Na2CO3 BaCl2 |
16.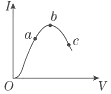 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
CH3COOH、H2CO3、HClO,其中酸性最强的是CH3COOH,最弱的是HClO
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为c<a<b
(2)a、b、c三点处,电离程度最大的是c
(3)表是几种常见弱酸的电离平衡常数(25℃):
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH?CH3COO-+H | K=1.76×10-5 |
| H2CO3 | H2CO3?H++HCO3-H2CO3-?H++HCO32- | K1=4.31×10-7K2=5.61×10-11 |
| HClO | HClO?H++ClO- | K=3.0×10-8 |
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4H2SO4═2H++SO42-
②NH3•H2ONH3•H2O?NH4++OH-.
3.下列关于钠及其化合物的说法中正确的是( )
| A. | 将2.3 g Na投入到97.7 g水中充分反应,所得溶液的质量分数为4.0% | |
| B. | 相同质量的铝分别与足量的盐酸和NaOH溶液反应,生成气体物质的量之比为1:3 | |
| C. | 将CO2和H2O的混合气体a mol,与足量的Na2O2固体充分反应,生成的O2在标准状况下的体积为11.2a L | |
| D. | 120 mL含有0.20 mol碳酸钠的溶液与200 mL盐酸进行滴加反应,不管将前者滴入后者,还是后者滴入前者,滴加完全后,产生的气体在相同条件下体积不等,则盐酸的浓度可能为2 mol/L |
1.下列关于平衡体系的各说法中不正确的是( )
| A. | 在N2+3H2?2NH3的平衡体系中,缩小体积,平衡向右移动,氨的产率增加 | |
| B. | 在CH3COOH?CH3COO-+H+的平衡体系中加入CH3COONa固体,平衡向左移动 | |
| C. | 对Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),升高温度,其Ksp一定增大 | |
| D. | 在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,平衡向溶解的方向移动 |

 .
.