题目内容
下列反应中不需加热的吸热反应是( )
| A、锌粒与稀硫酸的反应 |
| B、灼热的木炭与CO2反应 |
| C、甲烷在氧气中的燃烧反应 |
| D、Ba(OH)2?8H2O晶体与NH4Cl晶体的反应 |
考点:吸热反应和放热反应
专题:化学反应中的能量变化
分析:根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答:
解:A.锌粒与稀硫酸的反应是金属与酸反应,是常见放热反应,故A错误;
B.灼热的木炭与CO2反应是个别化合反应,是常见的吸热反应,常温下不能反应,需要高温加热,故B错误;
C.甲烷在氧气中的燃烧是物质的燃烧,是常见的放热反应,故C错误;
D.Ba(OH)2?8H2O晶体与NH4Cl晶体的反应,是常见的吸热反应,常温下就能进行,故D正确;
故选:D.
B.灼热的木炭与CO2反应是个别化合反应,是常见的吸热反应,常温下不能反应,需要高温加热,故B错误;
C.甲烷在氧气中的燃烧是物质的燃烧,是常见的放热反应,故C错误;
D.Ba(OH)2?8H2O晶体与NH4Cl晶体的反应,是常见的吸热反应,常温下就能进行,故D正确;
故选:D.
点评:本题考查吸热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列图示的装置可以构成原电池的是( )
A、 稀H2SO 4 稀H2SO 4 |
B、 稀H2SO 4 |
C、 稀H2SO 4 |
D、 酒精 |
已知C+CO2?2CO,正反应是吸热反应,反应速率为v1;N2+3H2?2NH3,正反应是放热反应,反应速率为v2.对于上述反应,当温度升高时,v1和v2的变化情况为( )
| A、都增大 |
| B、都减小 |
| C、v1增大,v2减小 |
| D、v1减小,v2增大 |
常用的电池是一个液体电解质将两个固体电极隔开.而钠-硫(Na/S8)电池正相反,它是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+通过.下列有关说法不正确的是( )
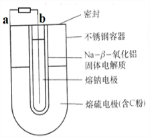

| A、a为电池的正极 |
| B、充电时b接电源的正极 |
| C、正极反应为:nS8+16ne-=8Sn2- |
| D、Na+可以穿过固体电解质和硫反应从而传递电流 |
关于氢键的下列说法中正确的是( )
| A、每个水分子内含有两个氢键 |
| B、在水蒸气、水和冰中都含有氢键 |
| C、HF的稳定性很强,是因为其分子间能形成氢键 |
| D、分子间能形成氢键使物质的熔点和沸点升高 |
下列粒子中,与OH-具有相同质子数和电子数的是( )
| A、Cl- |
| B、F- |
| C、NH3 |
| D、NH4+ |
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、标准状况下,2.24 L SO2中约含有0.1NA个分子 |
| B、常温常压下,32g氧气和32g臭氧所含氧原子总数为2NA |
| C、18g D2O所含有的电子数为10NA |
| D、5.6gFe与足量Cl2反应转移的电子数为0.2NA |
下列关于元素周期表的说法正确的是( )
| A、能生成碱的金属元素都在 IA族 |
| B、稀有气体元素原子的最外层电子数均为8 |
| C、第二周期 VIA族元素的原子核电荷数和中子数一定为8 |
| D、原子序数为14的元素位于元素周期表的第3周期ⅣA族 |