题目内容
 在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:
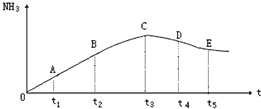
在容积不变的密闭容器中,分别充入1.0mol N2和3.0molH2,任其发生反应:N2(g)+3H2(g)?2NH3(g),分别在不同时刻测定NH3的含量,然后绘制出如图试回答下列问题:
(1)A、B、C、D、E五点中,尚未达到平衡状态的是:
(2)此可逆反应的正反应是
(3)A、C段的曲线是增函数,C、E段曲线是减函数,试从反应速率和化学平衡的角度说明理由:
(4)若在另一个等容积的密闭容器中充入2.0mol N2和6.0molH2,并使两个容器在相同的温度下进行反应,则该容器中的化学反应速率
(5)在一定条件下(反应物、生成物均为气态),N2和H2完全反应生成1molNH3放热46.0kJ热量.写出氨气分解为氢气和氮气的热化学方程式
考点:化学平衡的影响因素,热化学方程式,化学平衡建立的过程
专题:化学反应中的能量变化,化学平衡专题
分析:(1)分析图象可知氨气的含量随时间变化增大到C达到最大说明达到平衡状态,C点后是改变条件平衡逆向进行,氨气含量减小;
(2)依据图象变化和氨气的含量变化分析,结合平衡状态形成分析判断能量变化;
(3)AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动;
(4)等容积的密闭容器中充入2.0mol N2和6.0molH2,并使两个容器在相同的温度下进行反应,相当于原来的两个平衡叠加,平衡体系压强增大,平衡正向进行;
(5)依据热化学方程式书写方法,标注物质聚集状态和对应反应焓变写出.
(2)依据图象变化和氨气的含量变化分析,结合平衡状态形成分析判断能量变化;
(3)AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动;
(4)等容积的密闭容器中充入2.0mol N2和6.0molH2,并使两个容器在相同的温度下进行反应,相当于原来的两个平衡叠加,平衡体系压强增大,平衡正向进行;
(5)依据热化学方程式书写方法,标注物质聚集状态和对应反应焓变写出.
解答:
解:(1)图象可知氨气的含量随时间变化增大到C达到最大说明达到平衡状态,C点后是改变条件平衡逆向进行,氨气含量减小;
故答案为:AB;
(2)AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
故答案为:放热;
(3)图象分析可知,AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
故答案为:AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
(4)若在另一个等容积的密闭容器中充入2.0mol N2和6.0molH2,并使两个容器在相同的温度下进行反应,相当于原来的两个平衡叠加,平衡体系压强增大,平衡正向进行,该容器中的化学反应速率大于原来反应速率;
故答案为:>;
(5)在一定条件下(反应物、生成物均为气态),N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解吸热为92KJ;写出氨气分解为氢气和氮气的热化学方程式为:2NH3(g)?3H2(g)+N2(g)△H=92KJ/mol;
故答案为:2NH3(g)?3H2(g)+N2(g)△H=92KJ/mol.
故答案为:AB;
(2)AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
故答案为:放热;
(3)图象分析可知,AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
故答案为:AC是增函数因为此时反应未达到平衡状态,反应仍向正反应方向移动,所以氨气含量在这段是增加的,CE段达到平衡状态,升温使得平衡向逆反应方向移动,所以氨气含量减小,所以正反应为放热反应;
(4)若在另一个等容积的密闭容器中充入2.0mol N2和6.0molH2,并使两个容器在相同的温度下进行反应,相当于原来的两个平衡叠加,平衡体系压强增大,平衡正向进行,该容器中的化学反应速率大于原来反应速率;
故答案为:>;
(5)在一定条件下(反应物、生成物均为气态),N2和H2完全反应生成1molNH3放热46.0kJ热量,生成2mol氨气放热92KJ,氨气分解吸热为92KJ;写出氨气分解为氢气和氮气的热化学方程式为:2NH3(g)?3H2(g)+N2(g)△H=92KJ/mol;
故答案为:2NH3(g)?3H2(g)+N2(g)△H=92KJ/mol.
点评:本题考查了化学平衡影响因素分析判断,图象变化特征分析应用,平衡移动原理的理解判断,热化学方程式书写,掌握基础是关键,题目较简单.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
在一定温度下,反应A2(g)+B2(g)=2AB(g)达到平衡的标志是( )
| A、容器内的总压不随时间变化 |
| B、单位时间生成nmol的A2同时生成2nmol的AB |
| C、单位时间生成2nmol的AB同时消耗nmol的B2 |
| D、单位时间生成nmol的A2同时生成nmol的B2 |
 A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中的常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去). 请根据如图所示实验过程和数据计算:
请根据如图所示实验过程和数据计算: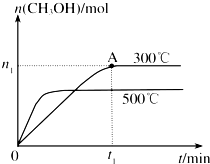 甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)
甲醇是一种可再生燃料.在容积为2L的密闭容器中进行反应:CO(g)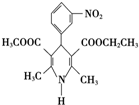 尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下:
尼群地平片可用于治疗高血压.其药理作用是引起冠状动脉、肾小动脉等全身血管扩张,产生降压作用.它的主要成分的结构简式如下: